Kardiogener Schock
Gutes Timing ist alles

Es kann überall passieren[1]



Von kardiogenem Schock betroffene Patientinnen und Patienten spiegeln ein breites Spektrum von Erkrankungen wider, die eine maßgeschneiderte Therapie zur Behandlung von hämodynamischen Störungen erfordern.[2]
Entwicklung eines Behandlungsplans
Erkennen
Jeder Versuch, die Ergebnisse der Behandlung zu verbessern, sollte mit einer frühzeitigen Erkennung des kardiogenen Schocks beginnen. Behandlungsmodelle mit einem multidisziplinären CS-Team haben das Potenzial für die frühzeitige Erkennung und die individualisierte Behandlung eines CS.[3]
Frühzeitig eingreifen
Fachleute empfehlen, ein erweitertes hämodynamisches Monitoring zur Diagnose und/oder Behandlung von Patientinnen und Patienten mit kardiogenem Schock einzusetzen.[4] Um die negativen Auswirkungen von Inotropika zu vermeiden, sollte eine frühzeitige Einleitung der Therapie mit intra-aortalen Ballonpumpen in Betracht gezogen werden.[5],[6]
Evaluieren
Um das Ansprechen auf die einleitenden Therapien beurteilen zu können, bedarf es schneller Feedback-Schleifen, die den Patientenstatus und die Hämodynamik einbeziehen.[2]
Eskalieren
Wenn Patientinnen und Patienten auf die eingeleiteten Behandlungen nicht ansprechen, sollten Sie die nächste Stufe der Unterstützung oder gegebenenfalls die Verlegung in ein erfahrenes Schockzentrum in Betracht ziehen.[4]
Früherkennung ist entscheidend
Stadien des kardiogenen Schocks [4]
Gefährdet (At Risk): Eine Patientin/ein Patient mit Risikofaktoren für einen kardiogenen Schock, die/der derzeit keine Anzeichen oder Symptome aufweist. Zum Beispiel ausgedehnter akuter Myokardinfarkt, Prä-Infarkt, akut und/oder akut bei chronischer Herzinsuffizienz.
Beginnend (Beginning): Ein Patient, bei dem es klinische Anzeichen für eine relative Hypotonie oder Tachykardie ohne Hypoperfusion gibt.
Klassischer Fall (Classic): Ein Patient, der sich mit einer Hypoperfusion vorstellt, die eine Intervention erfordert, welche über die Volumenwiederbelebung hinausgeht (inotrope, druckstabilisierende oder mechanische Unterstützung). Diese Patienten weisen in der Regel eine relative Hypotonie auf.
Verschlechterung (Deteriorating): Ein Patient, der nicht auf erste Interventionen reagiert. Ähnlich wie in Phase C und mit Verschlechterung.
Extremfall (Extremis): Ein Patient, der durch multiple Interventionen unterstützt wird und möglicherweise einen Herzstillstand unter laufender HLW erleidet.
Jeder Versuch, die Ergebnisse der Behandlung zu verbessern, sollte mit der Früherkennung des kardiogenen Schocks beginnen. Behandlungsmodelle mit einem multidisziplinären CS-Team haben das Potenzial für eine frühzeitige Erkennung und eine individualisierte Behandlung.[3]
Frühzeitige Einleitung
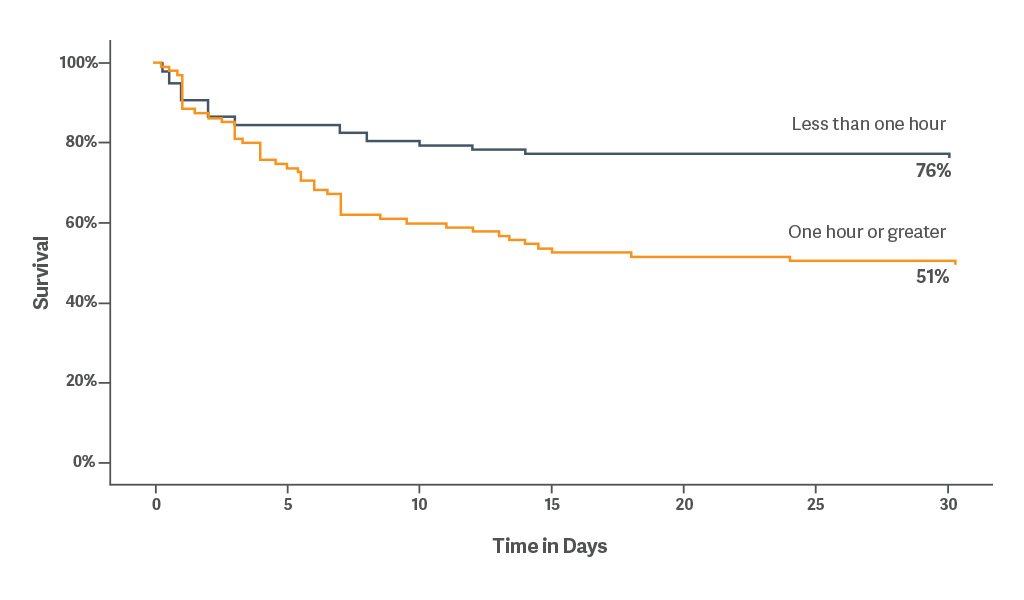
Die retrospektive Analyse zeigt, dass die frühzeitige Anwendung der mechanischen Kreislaufunterstützung (MCS) eine wichtige therapeutische Intervention ist. Die frühzeitige Anwendung der intraaortalen Ballongegenpulsation ist unabhängig von der Ätiologie mit Überlebensvorteilen verbunden. [5]
Die 30-Tage-Überlebensrate lag bei 76 %, wenn die IABP innerhalb von 60 Minuten nach Beginn des kardiogenen Schocks platziert wurde.[5]
Ein frühzeitiger Beginn der IABP-Therapie kann als Primärbehandlung der fortgeschrittenen dekompensierten Herzinsuffizienz einen hämodynamischen Nutzen bieten.[6]
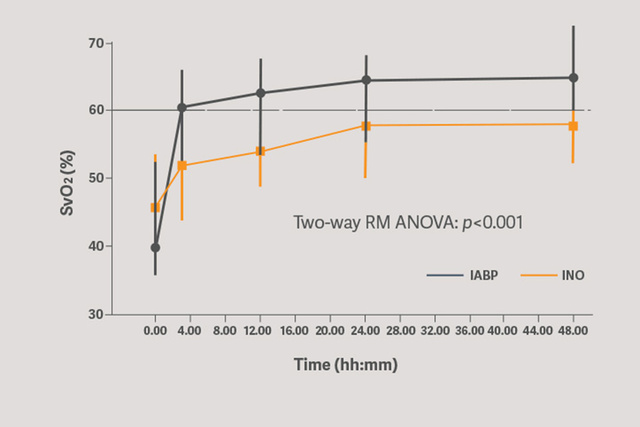
Die primäre Kreislaufunterstützung mit dem Sensation Plus 50 ml IAB-Katheter zeigte eine signifikante Verbesserung der Organperfusion bei der Bewertung mittels SVO2.[6]
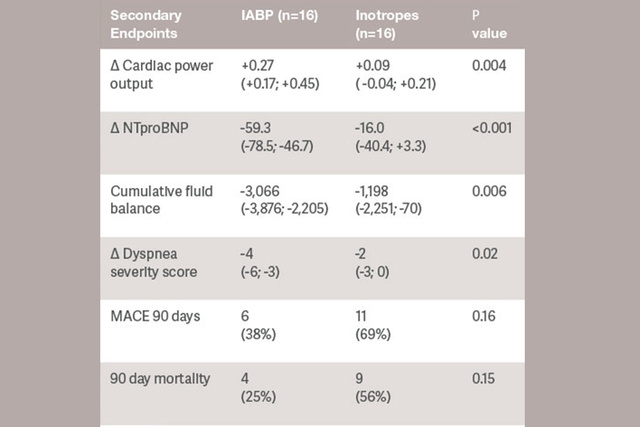
Der Beginn der Unterstützung reduziert sofort das Schlaganfallrisiko und senkt möglicherweise den myokardialen Sauerstoffverbrauch. Die IABP-Gegenpulsation verringert die LV-Nachlast, die Vorlast und die intraventrikuläre Dyssynchronie.[6]
Die Wirksamkeit bewerten
Schneiden Sie die Betreuung individuell auf die Patientin/den Patienten zu und eskalieren Sie bei Bedarf. Die Bewertung des Ansprechens auf die Therapie ist entscheidend für Anpassungen des Pflegeplans.[2]
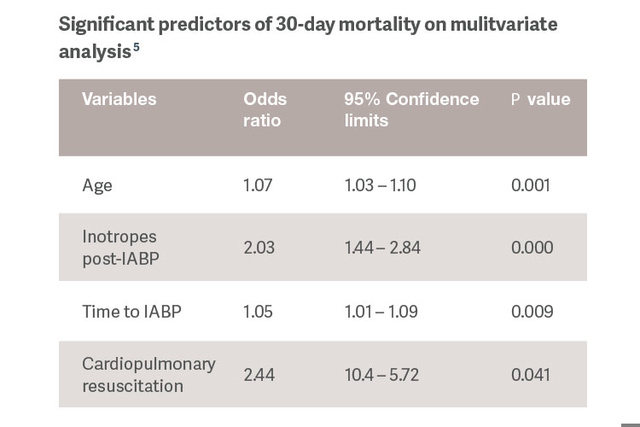
Die Identifizierung von Prädiktoren für die Reaktion auf die IABP-Unterstützung würde es uns ermöglichen, die Therapie individuell anzupassen und den Einsatz leistungsfähigerer MCS-Geräte für Patientinnen und Patienten in fortgeschrittenen Stadien des CS vorzusehen.[5]
IABP: die sichere MCS-Erstlinientherapie
| Artikel | Anzahl der Patientinnen und Patienten | Mortalität | Blutung | Schlaganfall | Vaskuläre Komplikationen |
AKI |
| Dhruva 2019[8] | 1680 Übereinstimmende Paare aus dem NCDR* |
Bevorzugt IAB Absolute Differenz 10,9 % |
Bevorzugt IAB Absolute Differenz 15,4 % |
NA | NA | NA |
| Amin 2019[9] | 48.306 Führende Datenbank* |
Bevorzugt IAB p < 0,0001 |
Bevorzugt IAB p = 0,045 |
Bevorzugt IAB p < 0,0001 |
NA | Bevorzugt IAB p = 0,052 |
| Wernly 2019[10] | 588 Meta-Analyse aus 4 RCT** |
Kein Unterschied p = 0,38 |
Bevorzugt IAB p = 0,002 |
Kein Unterschied p = 1,00 |
Bevorzugt IAB p = 0,01 |
NA |
| Schrage 2011[11] | 237 Übereinstimmende Paare aus IABP-Shock II** |
Kein Unterschied p = 0,64 |
Bevorzugt IAB p < 0,01 |
NA | Bevorzugt IAB p = 0,01 |
NA |
*Impella vs. IABP
**Impella vs. Kontrollgruppe (IABP und/oder medizinische Behandlung)
Komplikationen spielen eine Rolle
Keine erhöhten Blutungen mit IABP
| Studie | IABP | Keine IABP |
P-Wert |
| CRISP AMI: schwere Blutungen[12] | 3,1 % | 1,7 % | 0,49 |
| CRISP AMI: große vaskuläre[12] | 4,3 % | 1,1 % | 0,09 |
| SHOCK II: mäßige Blutungen[13] | 17,3 % | 16..4% | 0,77 |
| SHOCK II: schwere Blutungen[13] | 3,3 % | 4,4 % | 0,51 |
| SHOCK II: große vaskuläre[13] | 4,3 % | 3,4 % | 0,53 |
Registrierung zur Studie: CRISP AMI, n = 337; SHOCK II, n = 600