Die volle Kraft der Synchronie entfalten
Stellen Sie sich vor, Beatmungsstrategien für jeden Patienten – Atemzug für Atemzug – zu personalisieren, um eine noch lungenschonendere und zwerchfellschonendere Beatmung (LDPV) zu ermöglichen.
Ergänzend zu unseren individuellsten Beatmungsmodi, NAVA und NIV NAVA, führen wir nun Neural Pressure Support (NPS) und Non-invasive Neural Pressure Support (NIV NPS) ein.
Diese einzigartigen Modi – verfügbar als Optionen für das Beatmungssystem Servo-u – wurden entwickelt, um die Patient-Ventilator-Synchronie bei komplexen und herausfordernden Intensivpatienten zu verbessern und so bessere Behandlungsergebnisse zu ermöglichen.
Die volle Kraft der Synchronie entfalten
Das Zwerchfell und VIDD
Das Zwerchfell ist in vielerlei Hinsicht der wichtigste Skelettmuskel für den Erhalt des Lebens. Es unterstützt maßgeblich die Sauerstoffaufnahme und die Abgabe von CO₂, um einen gesunden, normwertigen pH-Wert im Blut aufrechtzuerhalten. Seine kontinuierliche Aktivität ist – Atemzug für Atemzug – grundlegend für die Funktion von Lunge, Herz und Gehirn.[1]
Die beatmungsinduzierte Zwerchfell-Dysfunktion (VIDD) ist bei beatmeten Intensivpatient*innen weit verbreitet und steht in Zusammenhang mit dem Behandlungsergebnis. Zentrale Ursachen sind die Inaktivitätsatrophie des Zwerchfells infolge lang andauernder kontrollierter Beatmung, übermäßiger Beatmungsunterstützung und Sedierung.[2],[3],[4]
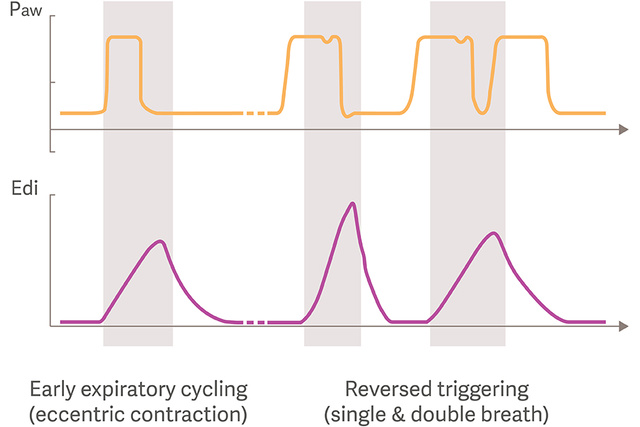
Asynchronien und VIDD
Die zunehmende Forschung und das wachsende klinische Bewusstsein für die Bedeutung des Zwerchfells, VIDD und deren Auswirkungen haben kürzlich auch gezeigt, dass eine frühzeitige Beendigung des inspiratorischen Flusses – mit potenziell schädlichen exzentrischen Zwerchfellkontraktionen – bei der druckunterstützten Beatmung häufig auftritt.[5]
Reverse Triggering ist eine weitere häufige Form der Asynchronie, bei der das Zwerchfell durch passive Beatmungsinflationen aktiviert wird. Auch dies kann potenziell schädliche exzentrische Zwerchfellkontraktionen sowie Doppeltriggerungen hervorrufen.[6],[7]
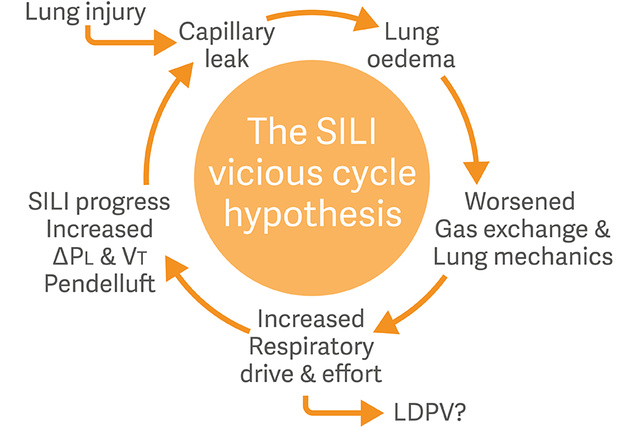
Atemantrieb, Atemarbeit und SILI
Ein weiteres Konzept, das sich als zentrale Herausforderung für das intensivmedizinische Fachpersonal herauskristallisiert hat, ist die Self-inflicted lung injury (SILI) – eine Lungenschädigung, bei der der Atemantrieb und die Atemarbeit eine besondere Rolle spielen.
Wenn sich die Lunge durch eine Kombination aus positivem Beatmungsdruck und negativem, vom Patienten erzeugtem Druck ausdehnt, kann dies zu einem potenziell schädlichen, lungenüberdehnenden transpulmonalen Druck führen.[8],[9]
Eine gezielte Überwachung und Steuerung des Atemantriebs und der inspiratorischen Anstrengung der Patient*innen wird heute empfohlen, um das Risiko für SILI zu minimieren.[10]
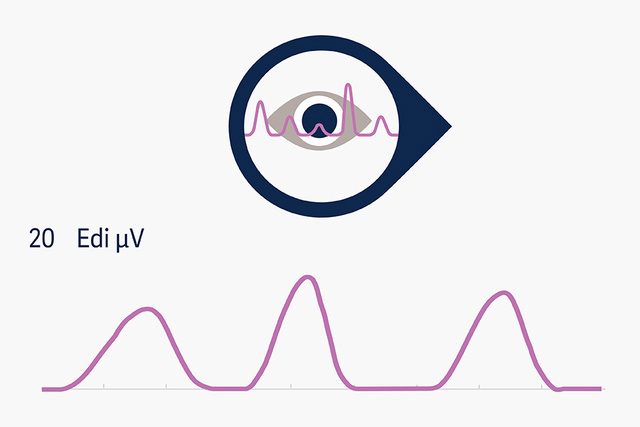
Edi-Überwachung
Die Überwachung der elektrischen Aktivität des Zwerchfells (Edi) ermöglicht einen kontinuierlichen Einblick in den Atemantrieb der Patient*innen und hat sich als Prädiktor für den Extubationserfolg erwiesen – mit früheren Hinweisen als herkömmliche Weaning-Parameter.[11],[12]
Darüber hinaus wurden zur Überwachung der inspiratorischen Anstrengung – mit dem Ziel, lungenüberdehnende Drücke zu beurteilen – neue Methoden auf Basis statischer und dynamischer Beatmungsmanöver vorgeschlagen, die künftig in der klinischen Praxis Anwendung finden könnten.[13],[14],[15]
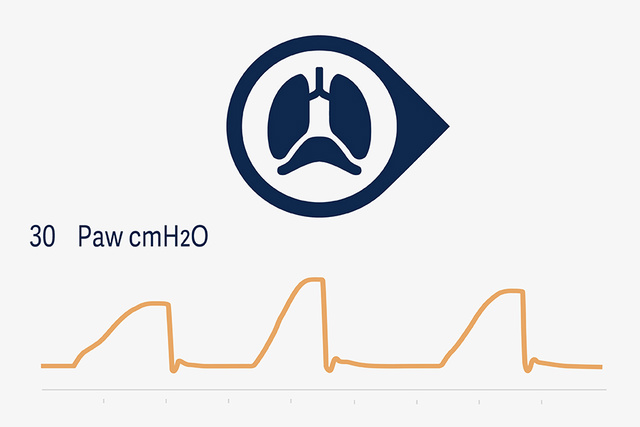
NAVA und NIV NAVA
Eine große, randomisierte, multizentrische Studie zeigte, dass NAVA die Zahl der beatmungsfreien Tage signifikant erhöhte und die Dauer der mechanischen Beatmung um nahezu 35 % verkürzte.[16]
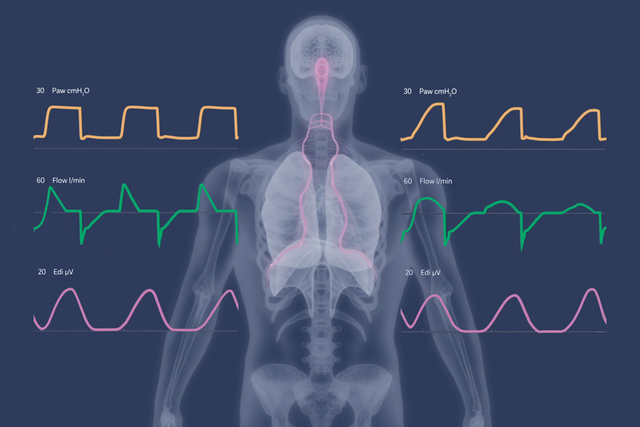
Die lungen- und zwerchfellschonenden Prinzipien von NAVA beruhen darauf, dass das Tidalvolumen vom Atemzentrum der Patient*innen gesteuert wird. Der bereitgestellte inspiratorische Druck ist dabei synchron und proportional zur Aktivität der Zwerchfellmuskulatur – diese ist für das intensivmedizinische Personal kontinuierlich sichtbar.[17],[18],[19]
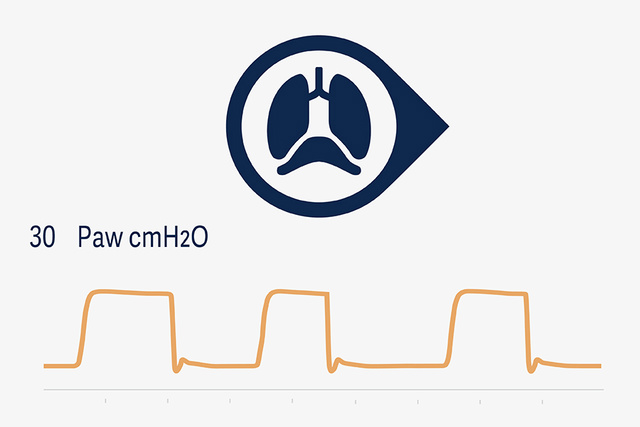
NPS und NIV NPS
Die neuen NPS-Modi bieten Kliniker*innen die Möglichkeit, eine druckunterstützte Beatmung (PS) mit neuralem Trigger und atemphasengerechter Zyklusbeendigung in Synchronisation mit der Zwerchfellaktivität einzustellen. Dies kann die Häufigkeit vorzeitiger Ausatmungszyklen reduzieren und zugleich das Risiko schädlicher exzentrischer Zwerchfellkontraktionen minimieren – ein Phänomen, das bei konventioneller, flussgesteuerter PS häufig beobachtet wurde.[20],[21],[22]
Eine besondere Chance, die sowohl NAVA als auch NPS bieten, ist das Prinzip der Echtzeit-Titration der Beatmungsunterstützung auf eine Zielzone des neuronalen Atemantriebs – und damit die Sicherstellung einer angemessenen Zwerchfellaktivität.
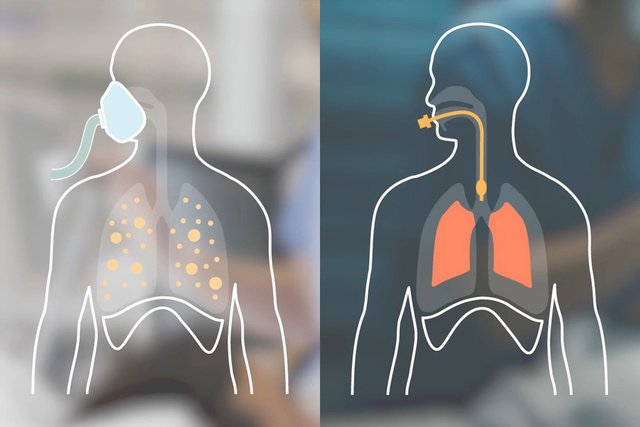
Restriktive und obstruktive Lungen
Im Vergleich zu NAVA kann die schnellere Druckaufbaurate in NPS Vorteile im Management von restriktiven (z. B. ARDS) und obstruktiven (z. B. COPD) Patient*innen bieten – insbesondere bei solchen mit hohem Atemantrieb, der zu übermäßigen, lungenüberdehnenden Drücken beiträgt.[20],[22]
Sollte sich der Atemantrieb und die inspiratorische Anstrengung der Patient*innen nicht von selbst auf lungenschonende Zielwerte regulieren, kann eine sorgfältige Titration der Inspirationsanstiegszeit und des PEEP erforderlich sein. Eine zusätzliche Kontrolle des Atemantriebs kann auch durch die gezielte Titration von Sedierung oder neuromuskulären Blockern erreicht werden.[23]

Kombination von NAVA und NPS
Ein besonderer Vorteil neural gesteuerter Beatmungsmodi besteht darin, dass sie ein gezieltes Muskeltraining auf physiologischere Edi-Niveaus ermöglichen. NAVA und NPS können im Wechsel eingesetzt werden – mit variierender Entlastung der Atemmuskulatur. Dabei ist die Trainingsintensität in NAVA höher, während NPS mehr Erholungsphasen bietet.[24],[25]
Zudem besteht die Möglichkeit, die Wahl des Modus zwischen Tag und Nacht anzupassen – beispielsweise wenn die Intensivstation nachts mit weniger spezialisiertem Fachpersonal besetzt ist, das im Umgang mit NAVA möglicherweise weniger erfahren ist als mit NPS.
Implementierung
Die NPS-Modi werden als Brücke zwischen konventioneller und neural gesteuerter Beatmung betrachtet. Durch die Kombination aus Edi-Überwachung, NAVA und NPS kann eine effektive Implementierung dieser Technologie in die klinische Praxis erleichtert werden – auch in einer komplexen und zeitkritischen Umgebung auf der Intensivstation.
Ein schrittweiser Implementierungsansatz kann verfolgt werden: Beginnend mit der reinen Edi-Überwachung, gefolgt von NPS – und abgerundet durch NAVA als Höhepunkt der personalisierten Beatmung.
Literatur und Schulung
Erfahren Sie mehr über die Vorteile von Getinges Ansatz zur personalisierten Beatmung sowie über unsere neuesten wegweisenden Technologien und Innovationen in der mechanischen Beatmung.
Schulung und Weiterbildung zu NPS & NAVA
Erfahren Sie mehr über die Beatmungsmodi NPS und NAVA auf unserer Academy-Weiterbildungsplattform.
Das Beatmungssystem Servo-u
Entdecken Sie die Servo-u eBrochure und erfahren Sie, wie unser Flaggschiff unter den Servo-Beatmungsgeräten Sie auf der Intensivstation unterstützen kann.

Servo-u Funktionen
Nutzen Sie das volle Potenzial Ihres Servo-u mit zusätzlichen Funktionen und unseren neuesten Softwareoptionen.