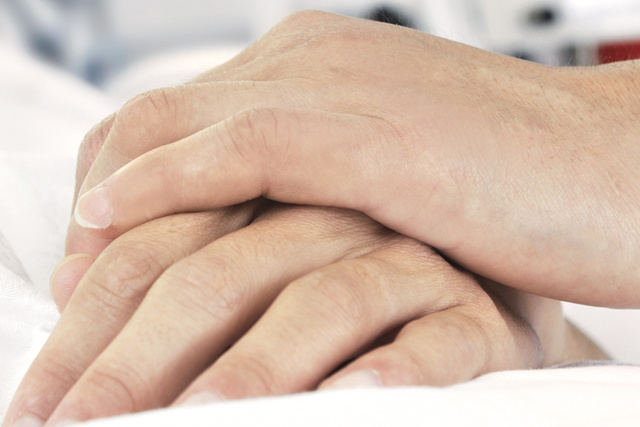
Répondez aux besoins de vos patients
Dans la plupart des unités de soins intensifs, 20% des patients nécessitent des ressources de ventilation importantes, ce qui peut mener à de plus grandes complications et à des effets indésirables. [31] Pour ces patients, la ventilation conventionnelle est simplement insuffisante. Lorsque le mode NAVA, qui fonctionne pour tout type et taille de patients, est activé sur un ventilateur Servo, celui-ci vous montre ce dont le patient a besoin. En combinaison avec d’autres outils de ventilation personnalisée, il vous aide à réduire les complications [9] [10] [29] [30], à surveiller et à réduire la sédation [5] [19] [20] [21], à obtenir un sevrage anticipé et plus efficace [3] [4] [8] [13] [14] et à raccourcir la durée de la ventilation mécanique [3] [20] [21].
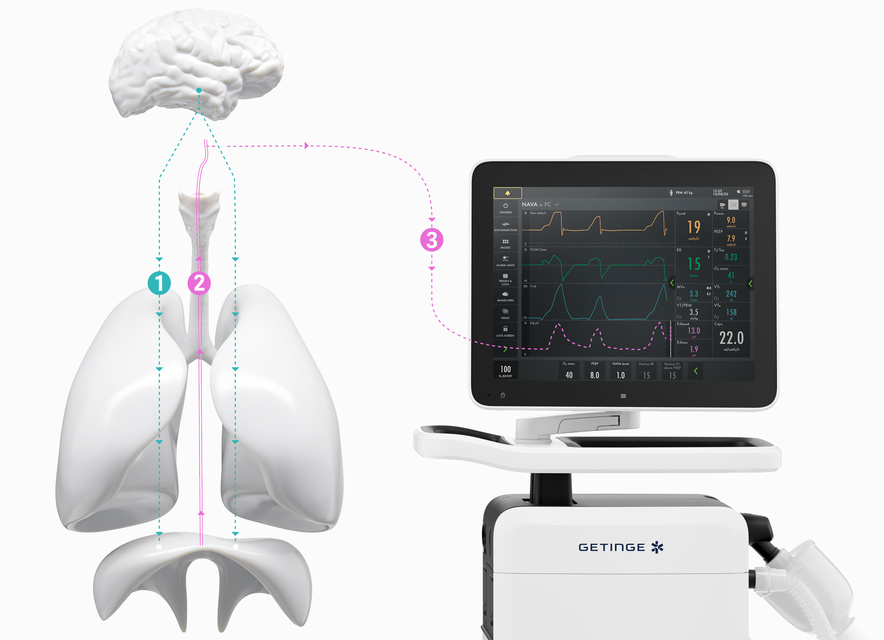
Comment réussir une ventilation personnalisée avec la technologie NAVA en trois étapes ?
Comment réussir une ventilation personnalisée avec la technologie NAVA en trois étapes ?
L'amplitude et la dur%E9e exactes de chaque respiration sont contr%F4l%E9es par le centre respiratoire du cerveau.
Une fois que le cerveau a trait%E9 les diff%E9rentes informations sensorielles, il envoie un signal par l%u2019interm%E9diaire du nerf phr%E9nique qui active %E9lectriquement le diaphragme, provoquant une contraction musculaire. Le diaphragme se contracte dans la cavit%E9 abdominale, se traduisant par un mouvement descendant, provoquant une expansion de la paroi thoracique et des poumons ainsi qu%u2019un afflux d'air.
L'activit%E9 %E9lectrique du diaphragme est captur%E9e par une sonde naso-gastrique sp%E9ciale %E9quip%E9e d%u2019une s%E9rie de micro-%E9lectrodes (cath%E9ter Edi).
Comme une sonde d'alimentation ent%E9rale ordinaire, le cath%E9ter Edi passe dans l'%u0153sophage o%F9 il mesure l%u2019activit%E9 %E9lectrique du diaphragme. Les %E9lectrodes du cath%E9ter Edi surveillent aussi les signaux %E9lectrocardiographiques (ECG) utilis%E9s pour guider et valider le bon positionnement par rapport au diaphragme.
Le signal Edi s%u2019affiche constamment en bas de l%u2019%E9cran, m%EAme lorsque la ventilation du patient n%u2019est pas configur%E9e en mode NAVA.
Dans la mesure o%F9 le mode NAVA est choisi, le signal Edi guide automatiquement le ventilateur pour fournir l%u2019assistance de mani%E8re synchronis%E9e et proportionnelle au diaphragme. Le ventilateur agit comme un second muscle respiratoire, en parfaite synchronisation avec celui du patient.
Les avantages de l’Edi
Le diaphragme est le centre du système respiratoire, il est prévu pour être actif en permanence. [26] L’Edi est un outil diagnostique de chevet qui permet de surveiller et de contrôler l’activité du diaphragme des patients. [27] [28] L’Edi guide le sevrage [29] pour éviter l’épuisement musculaire durant les tests de sevrage, même après l’extubation. [30]
Mentions légales
Cathéter Edi - Sonde d’alimentation entérale à usage unique équipée d’électrodes de mesure destinée à recueillir l’électromyogramme du diaphragme et disponible sur certains systèmes d’assistance respiratoire Maquet. Ce cathéter permet au mode NAVA d’offrir une assistance respiratoire proportionnelle et synchronisée au signal lié à l’activité électrique du diaphragme. Il s’agit d’un dispositif médical de classe IIa, CE0123. Produit fabriqué par Maquet Critical Care AB, Suède. Pour un bon usage, veuillez lire attentivement toutes les instructions figurant dans la notice d’utilisation du produit.
PUB-2022-0762-C, version de novembre 2023
Produits associés
Obtenir un sevrage personnalisé plus rapide avec une ventilation protectrice des poumons et du diaphragme
1. Monitorage Edi - le signe vital de la respiration, dès le premier jour
2. Protection et activation du diaphragme pour un sevrage anticipé
3. Protection des poumons en phase avec le patient

4. Amélioration de l’expérience globale du patient en réanimation
Monitorage Edi - le signe vital de la respiration
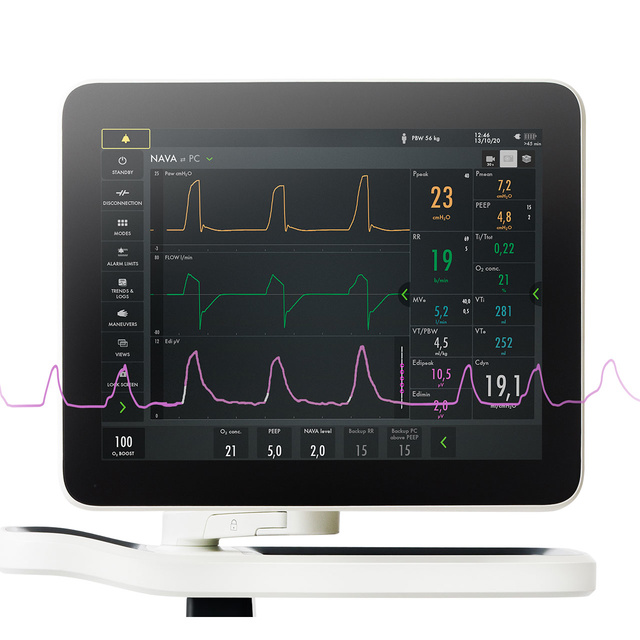
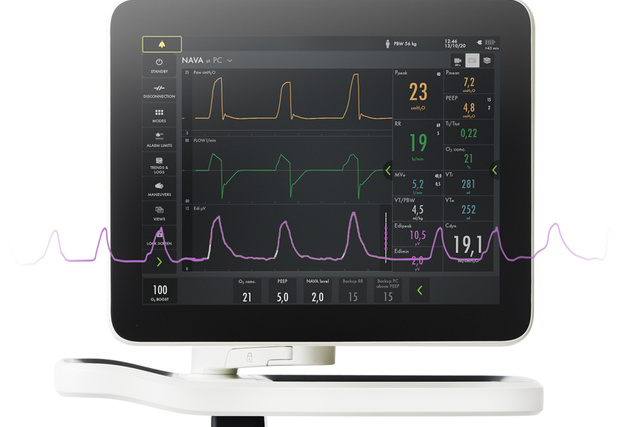
Outre l’effet de la ventilation mécanique sur la fonction pulmonaire, il est également impératif de surveiller les efforts respiratoires du patient et leur amplitude dès le début. Le monitorage Edi aide à prendre des décisions appropriées plus rapidement. Ce signe vital affiché en bas de l’écran vous permet de détecter les cas d’inactivité du diaphragme, d’hypersédation, d’asynchronisme entre le patient et le respirateur ainsi que de sur- ou sous-assistance. Il permet également de surveiller l’augmentation du travail respiratoire pendant les tests de sevrage et après l’extubation [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15].

Ventilation protectrice du diaphragme
Une ventilation mécanique non optimale peut rapidement conduire à une atrophie diaphragmatique ou à une lésion induite, accompagnée de mauvais résultats cliniques [16] [17]. Les principaux avantages physiologiques de la technologie NAVA reposent sur le fait que la réponse du ventilateur est toujours fournie de manière synchronisée et proportionnelle à la commande respiratoire du patient. Le monitorage diaphragmatique (Edi) est
immédiatement disponible sous forme d’outil diagnostique [1] [2]. La technologie NAVA raccourcit la durée du sevrage et augmente les chances de sa réussite[3][4].

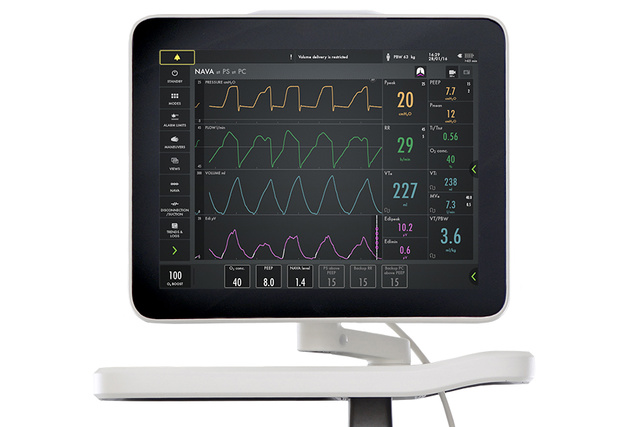
Ventilation pulmonaire protectrice
Une différence fondamentale entre le mode NAVA et les modes d’assistance conventionnels repose sur le fait que le volume courant est contrôlé par le signal d’impulsion neuro-électrique du centre respiratoire du patient. La distension pulmonaire est ainsi évitée grâce au réflexe d’Héring-Breuer qui inhibe l’inspiration lors de l’atteinte d’un volume courant élevé pour éviter l’hyperinflation. Par conséquent, il est possible d’obtenir une respiration spontanée protectrice des poumons dans la plage de protection de 6 à 8 ml/kg PP [1] [2] [18].
Expérience patient améliorée
Le mode NAVA permet d'améliorer l’expérience globale du patient en réanimation et aide les cliniciens à réduire la sédation si nécessaire, améliorant ainsi le confort tout comme la qualité du sommeil [19] [20] [21] [22] [23]. Le mode de ventilation NAVA, combiné au signal Edi, assurent l’évaluation effective des efforts respiratoires des patients et réagissent en conséquence. Pour les patients souffrant d’une exacerbation aigüe de la BPCO, notre mode VNI NAVA, insensible aux fuites, peut aider à gérer efficacement leur état et à éviter une intubation éventuelle [14] [24] [25] [26] [27] [28].
Assistance personnalisée tout au long du traitement
Mode NAVA invasif
Assistance synchronisée, prise en charge du sevrage et de la sédation, soutien de l’activation précoce du diaphragme.

Mode NAVA non invasif
Assistance synchronisée, indépendamment des fuites, ce qui permet une application plus douce avec un masque.
Monitorage Edi
Surveille l’activité du diaphragme et l’effort respiratoire après l’extubation. Peut être utilisé avec la thérapie à haut débit, le cas échéant.