Hoe diafragmamonitoring kan helpen de mechanische beademing te verbeteren
Beademingsondersteuning kan levens redden op de intensive care, maar als het niet correct wordt gedoseerd, verhoogt het ook het risico op ongewenste uitkomsten.[1],[2] Hierbij komt diafragmabewaking goed van pas, omdat het een indicator is voor uitkomsten zoals ziekenhuissterfte en langdurig weanen. Bovendien kan het helpen om weloverwogen behandelbeslissingen te nemen tijdens de beademing.
De klinische impact van diafragmaletsel
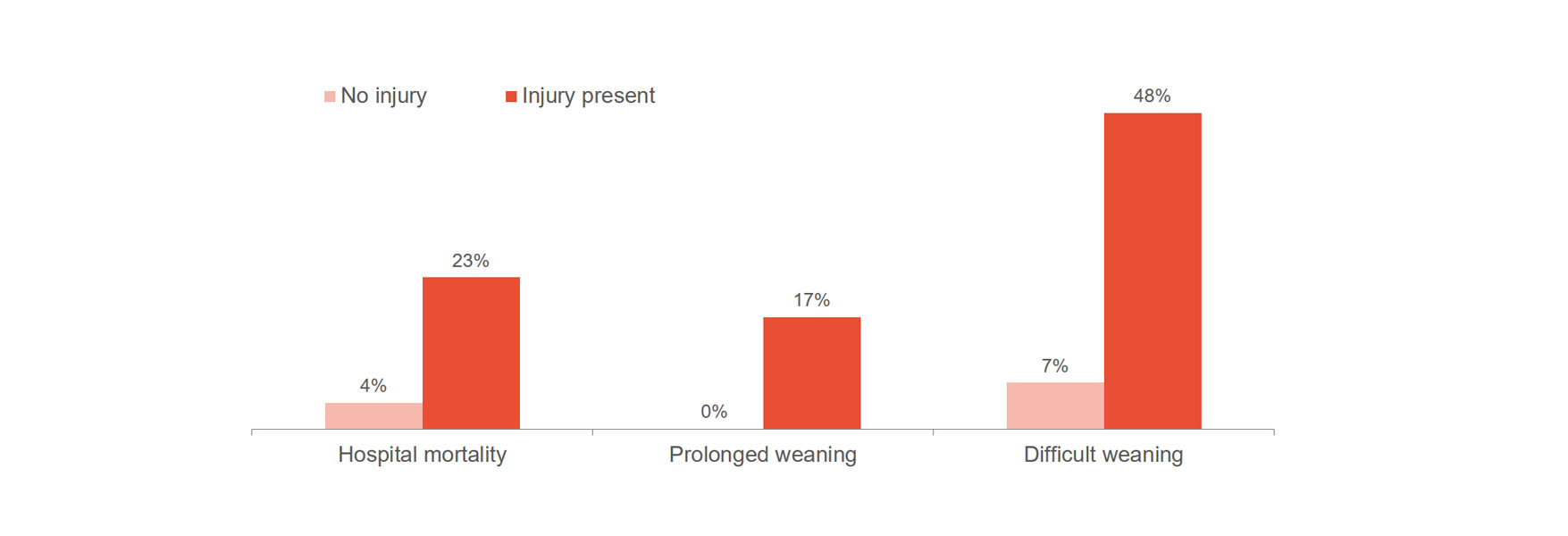
Diafragmaletsel vergroot het risico op slechtere behandelresultaten aanzienlijk, zoals moeilijk weanen, langdurig weanen en ziekenhuissterfte.[1],[2] 23-84% van de patiënten vertoont significante schade aan het middenrif bij de eerste poging tot spontane ademhaling.[3] Uit één onderzoek bleek dat patiënten met diafragmaletsel gemiddeld 576 uur aan beademing lagen, vergeleken met 203 uur voor patiënten zonder letsel.[4]
De belangrijkste oorzaken worden toegeschreven aan twee factoren.[1] In sommige gevallen spannen patiënten zich overmatig in om te ademen, wat leidt tot verdikking van het diafragma. In andere gevallen spannen patiënten zich te weinig in als gevolg van overmatige ondersteuning en/of gecontroleerde beademing aan het begin van de behandeling, wat resulteert in atrofie. In beide gevallen worden de uitkomsten negatief beïnvloed, en de grootste uitdaging voor clinici is momenteel dat de standaard diagnostische functie van beademingsapparatuur deze informatie niet vastlegt.
Waarom de huidige beademingsdiagnostiek niet voldoende is
Beademingscurven worden gebruikt om de ademhalingsbehoeften van de patiënt te interpreteren, maar hun primaire functie is om te laten zien wat u aan de patiënt toedient. Dit maakt het moeilijk om asynchronie, oversedatie, overbeademing en onderbeademing tijdens spontane ademhaling te detecteren.
Zo detecteert bijvoorbeeld slechts 21% van de clinici asynchronie in de vorm van gemiste inademingsinspanningen.[5] Bovendien kan het lijken alsof een patiënt die beademd wordt met drukondersteuning spontane ademhalingen triggert, terwijl er in werkelijkheid helemaal geen sprake is van spontane ademhaling.[5], [6]
Hierdoor ontstaat onzekerheid over de hoeveelheid ademhalingsinspanning die de patiënt verricht en in hoeverre hij of zij risico loopt op schade aan het diafragma.
Hoe kan het diafragma worden gemonitord
Om het diafragma te beschermen, moet u de mogelijke schade diagnosticeren en de voortdurende activiteit ervan in de gaten houden.
Een echografie kan helpen bij het beoordelen van disfunctie van het diafragma door de dikte en mogelijke veranderingen van de dikte in de loop van de tijd te meten. Recente ontwikkelingen in echografie stellen artsen in staat om de functie van het diafragma beter te beoordelen en het mogelijk te beschermen tijdens mechanische beademing.[7]
De elektrische activiteit van het diafragma (Edi) kan worden gebruikt om de functie van het diafragma continu te bewaken bij elke ademhaling. Dit diagnostische hulpmiddel voor aan het bed maakt gebruik van een speciale voedingssonde. Het Edi-signaal wordt weergegeven als een curve naast de conventionele druk-/flowcurven van de patiënt, wat de aanwezigheid, afwezigheid en het type ademhaling aangeeft.
Edi kan u helpen de ademhalingsinspanning te begrijpen, asynchronieën te detecteren en te beoordelen in hoeverre te veel of te weinig ondersteuning en sedatie het ademhalingsvermogen beïnvloeden.[8],[9] Het kan ook veranderingen in de ademhalingsinspanning detecteren na een interventie, zoals het veranderen van de positie van de patiënt, het toedienen van medicijnen zoals salbutamol of, cruciaal, het verminderen van de beademingsondersteuning tijdens het weanen.
Je zou kunnen stellen dat de combinatie van echografie en continue diafragmamonitoring (Edi) nodig is om een compleet beeld te krijgen.
Hoe diafragmamonitoring kan helpen patiënten te beschermen en het weanen te vereenvoudigen
Om longschade door beademing te voorkomen, moet u invasieve beademing, asynchronie, overmatige en ontoereikende ondersteuning en langere perioden van sedatie en diafragma-inactiviteit proberen te vermijden. Patiënten die 'tegen de beademing vechten' verliezen vaak. Verhoogde sedatie, langere beademingsduur en mogelijk intubatie zijn vaak het gevolg.
Diafragmamonitoring kan u helpen deze uitdagingen te overwinnen.[10],[11],[12] Het helpt u inspanning van de patiënt bij elke ademteug te beoordelen en het stelt u ook in staat om te zien of de beademingsmachine tijdig reageert en de juiste ondersteuning biedt. U beschikt over een objectieve, fysiologische waarde als leidraad.
Bij non-invasieve behandeling kunnen deze aspecten u helpen de timing en het niveau van beademingsondersteuning aan te passen, waardoor de noodzaak tot intubatie afneemt. Een goede interactie tussen patiënt en beademingsapparaat is een van de sleutelfactoren voor succesvolle NIV.[13]
Continue monitoring kan ook dienen als een realtime indicator van de ademhalingsinspanning, waardoor u beter begrijpt wanneer intubatie echt nodig is. Het kan u zelfs helpen de timing van spontane ademhalingspogingen te optimaliseren en succesvollere en frequentere vooruitgang te boeken.
Hoe diafragmabewaking kan helpen de beademingsduur te verkorten
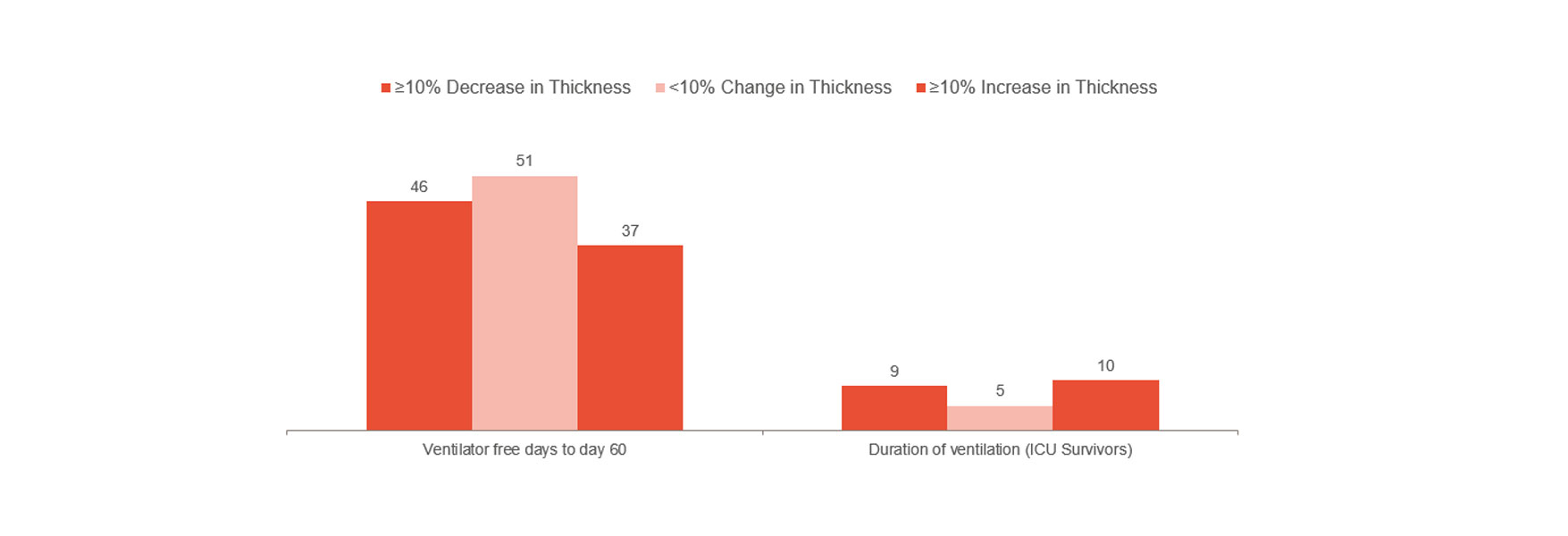
Goligher toonde aan dat vroege verandering van de dikte van het diafragma een indicator was voor de duur van het verblijf op de IC en andere complicaties zoals reïntubatie, tracheostomie, langdurige mechanische beademing en overlijden.[1] De studie suggereert dat een diafragmaverdikking die tussen de 10 en 20% blijft, optimaal zou zijn. Deze waarde kan een indicatie geven van het risico voor de patiënt en u helpen de behandeling te optimaliseren. Gerandomiseerde klinische studies zijn nodig om te begrijpen of het ook mogelijk is om complicaties te verminderen door diafragmaletsel te voorkomen.
De ervaring van een ziekenhuis in Londen komt echter overeen met de bovenstaande beweringen. Monitoring van de diafragma-activiteit resulteerde in een significante vermindering van de duur van de mechanische beademing.[14] De groep waarbij niet werd gemonitord lag gemiddeld 12 dagen aan de beademing, vergeleken met een gemiddelde van 9 dagen bij de groep waarvan de activiteit van het diafragma wel werd gemonitord (103 van de 493 patiënten).
Het monitoren van het diafragma kan ook helpen bij het opsporen van aandoeningen, zoals het congenitaal centraal hypoventilatiesyndroom en schade aan de nervus phrenicus.[15],[16]
Hoe diafragmamonitoring kan helpen om beter geïnformeerde behandelbeslissingen te nemen
Door de activiteit van het diafragma te monitoren, kunt u tijdens de behandeling weloverwogen beslissingen nemen voor uw patiënt. Bovendien biedt het waardevolle informatie op verschillende beslismomenten.
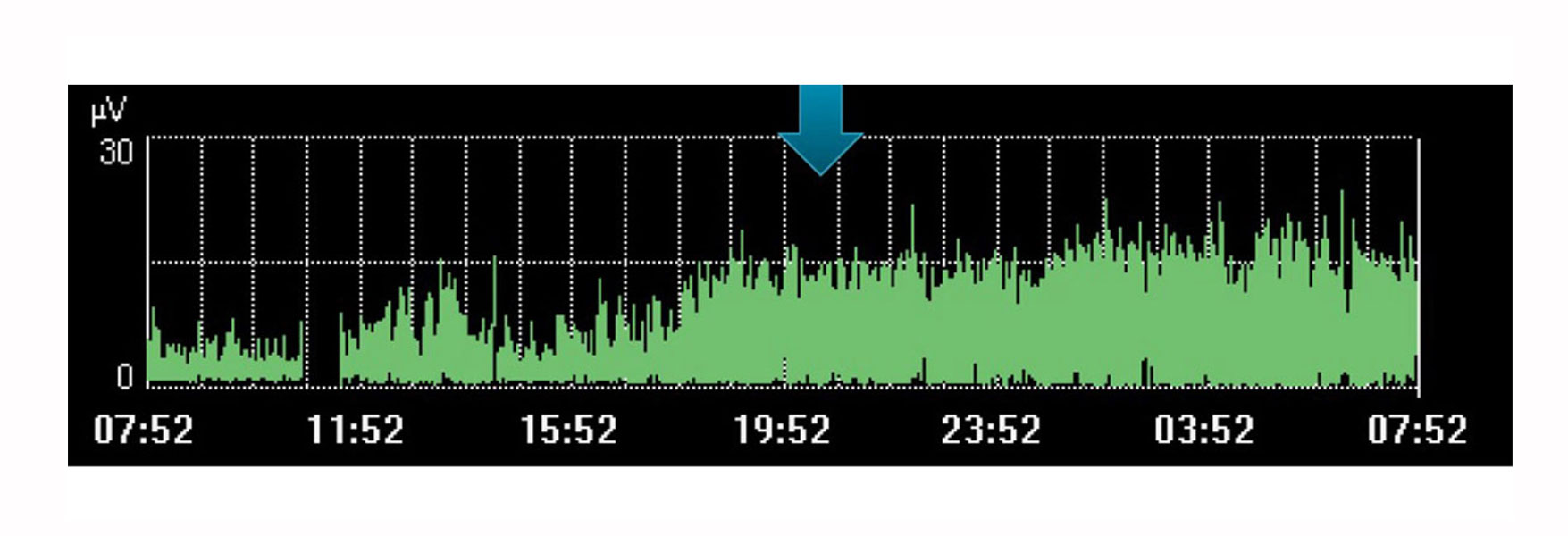
Monitoring en trends in ademhalingsinspanning
Uit recente rapporten blijkt dat diafragmamonitoring met Edi nuttig is om de ademhalingsinspanning en de interactie tussen patiënt en beademingsapparaat te bewaken.[18]
Natuurlijk heeft het monitoren van de elektrische activiteit van het diafragma als enkele, geïsoleerde waarde zijn beperkingen. Net als andere fysiologische variabelen moet het worden bekeken in samenhang met andere metingen en in de context van veranderingen in de therapie; een trend in de loop van de tijd die u kan helpen bepalen of uw patiënt in de gewenste richting vordert.
De afbeelding hierboven toont bijvoorbeeld een toename van de inspanning van het diafragma tijdens een periode waarin de arts rust voor de patiënt had gepland. De trend geeft aan dat dit niet is gebeurd, wat zichtbaar is aan de toegenomen inspanning van de patiënt gedurende deze periode.
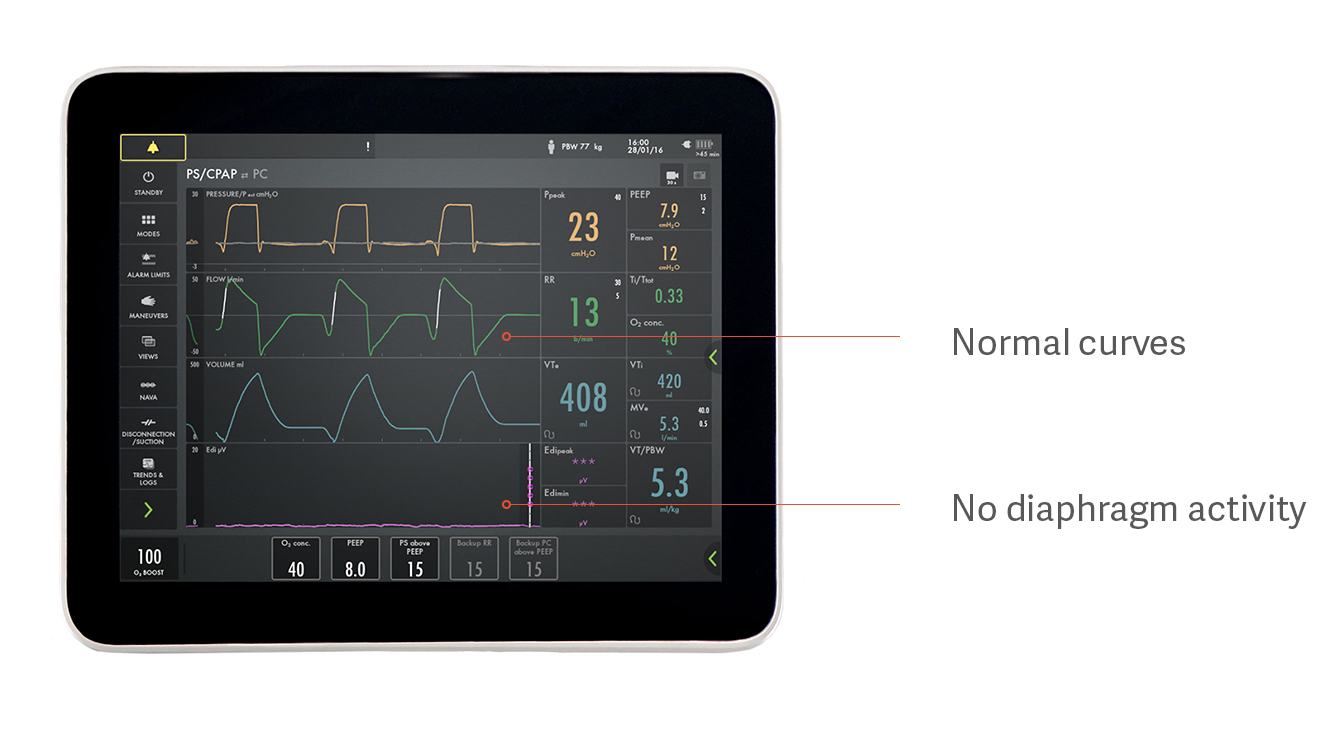
Identificeren van overmatige en ontoereikende ondersteuning
Om te voorkomen dat de patiënt diafragmaletsel oploopt, moet het diafragma op een passend niveau actief zijn. Dit is moeilijk te zien zonder diafragmamonitoring.
Een patiënt kan bijvoorbeeld spontaan ademen met drukondersteuning, maar in werkelijkheid zijn of haar diafragma helemaal niet gebruiken, zoals te zien is in de afbeelding hierboven. Dit is een voorbeeld van hoe overmatige ondersteuning de werking van het diafragma verhindert, wat resulteert in diafragma-atrofie. De druk-, flow- en volumecurven lijken normaal, maar het paarse Edi-signaal onderaan is vlak, wat wijst op een inactief diafragma.
Een ander voorbeeld is ontoereikende ondersteuning, wat het tegenovergestelde is van overbeademing en even slecht voor de patiënt. Een patiënt die ontoereikend ondersteund wordt, moet te veel moeite doen om te ademen, wat resulteert in een verdikking van het diafragma. Dit is misschien gemakkelijker te observeren bij de patiënt zelf, maar zonder een objectieve waarde op de beademingsmachine is het moeilijk om dit met zekerheid te zeggen.
Beide voorbeelden van diafragmaletsel (atrofie en verdikking) worden vaak gezien bij patiënten en gaan gepaard met verslechterde klinische uitkomsten.[1]
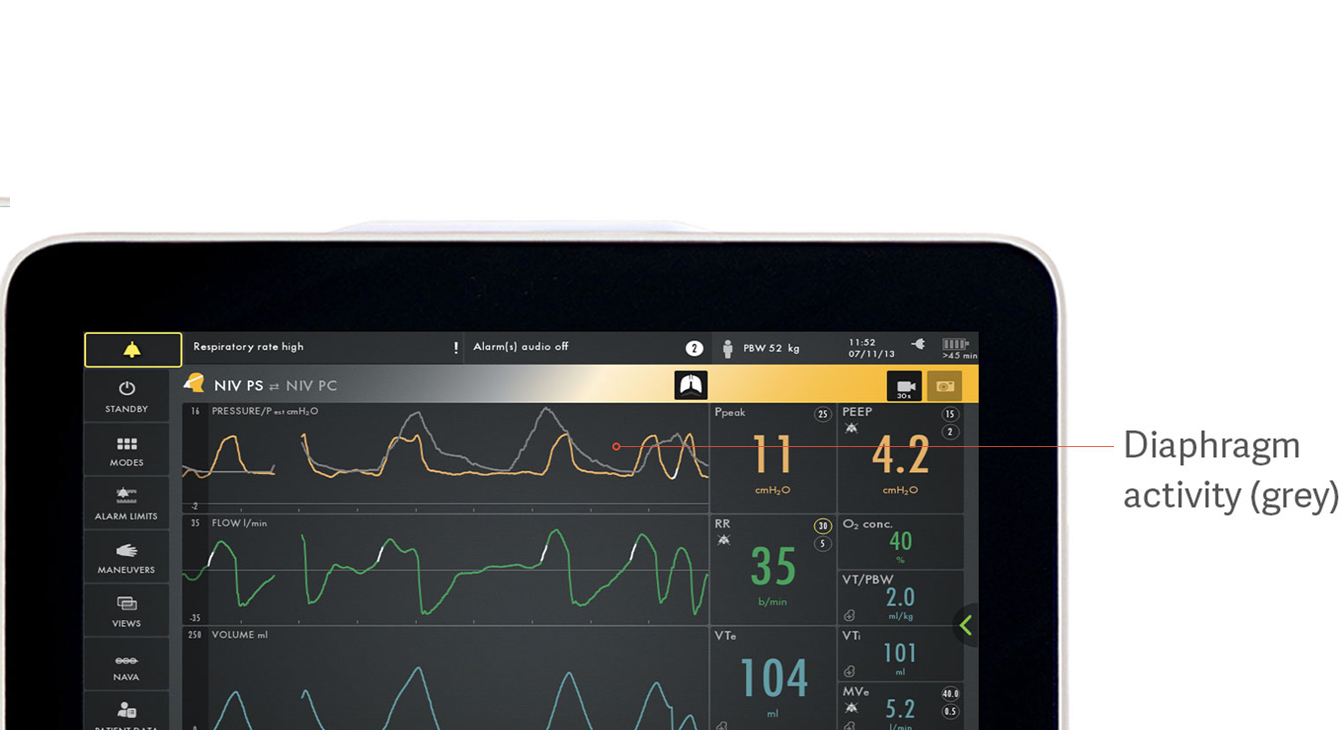
Identificeren van asynchronie tussen patiënt en beademingsapparaat
Asynchronie wordt geassocieerd met slechtere klinische uitkomsten tijdens mechanische ventilatie.[18] In een recent onderzoek slaagde slechts 21% van de artsen erin asynchronie te detecteren in de vorm van gemiste inademingsinspanningen.[5] Er zijn nog veel meer soorten asynchronie die gemakkelijk over het hoofd worden gezien: ineffectieve of overmatige inspanningen, vertraagde inademingsinspanning, vertraagde uitademing, dubbele triggering en auto-triggering.
In de afbeelding is te zien hoe de elektrische activiteit van het diafragma (grijs) over de drukcurve (geel) heen loopt. Zo zijn de verschillen tussen wat de patiënt vraagt en wat de beademingsmachine levert, goed te zien.
Bepalen van de beademingsmodus
Uw doel moet zijn ervoor te zorgen dat de patiënt optimaal kan blijven ademen, zonder te weinig of te veel inspanning te hoeven leveren.[1] Door de diafragma-activiteit continu te monitoren, krijgt u een indicatie van hoeveel inspanning de patiënt levert. Als de diafragma-activiteit hoog is en toeneemt, moet u mogelijk het ondersteuningsniveau verhogen.[19],[20],[21]
Als de activiteit laag is of afneemt, kunt u mogelijk het niveau van ondersteuning verlagen.[19] Het is belangrijk om ook andere diagnostische parameters te controleren die verband houden met beademing voordat u de ondersteuning verandert. Het onderzoek op dit gebied groeit. In de toekomst kan meer kennis over diafragmaparameters de beoordeling verder verbeteren.[22]
Instellen van een optimale PEEP
Er is geen gestandaardiseerde manier om de PEEP van de patiënt in te stellen tijdens spontane ademhaling. Toch kan een goed ingestelde PEEP atelectase, het cyclisch openen en sluiten van de luchtwegen verminderen en de alveoli beschermen. Dit optimaliseert op zijn beurt de longmechanica en verbetert de zuurstofvoorziening.
PEEP-titratie met diafragmamonitoring heeft positieve resultaten laten zien bij pasgeborenen, waardoor de baby goed kan ontspannen tussen de ademhalingen en longderecruitment wordt voorkomen.[12]
Bij volwassen patiënten gebruikte Passath diafragma- en zuurstofmonitoring tijdens PEEP-veranderingen om een PEEP-niveau te kunnen identificeren waarbij tidale ademhaling met minimale inspanning mogelijk is.[23] Een overmatige verlaging van PEEP resulteerde in een toename van de ademhalingsinspanning met 50 tot 60%, wat, in combinatie met een verslechtering van het zuurstofgehalte, ook duidde op gedeeltelijke longderecruitment.
Optimalisatie van sedatiemanagement
Het voornaamste voordeel van het monitoren van de activiteit van het diafragma in relatie tot sedatie is dat je probeert het diafragma zoveel mogelijk actief te houden.[1] Monitor simpelweg de activiteit van het diafragma van de patiënt en diens reactie op beademing, om een adequaat sedatieniveau te vinden met aanhoudende activiteit van het diafragma.
Het kan enige training vergen om het effect van de sedatie te kunnen onderscheiden van andere fysiologische factoren die de werking van het diafragma kunnen beïnvloeden. Edi is echter bijzonder effectief tijdens sedatiepauzes, omdat u voortdurend de veranderende inspanning van de patiënt kunt zien.
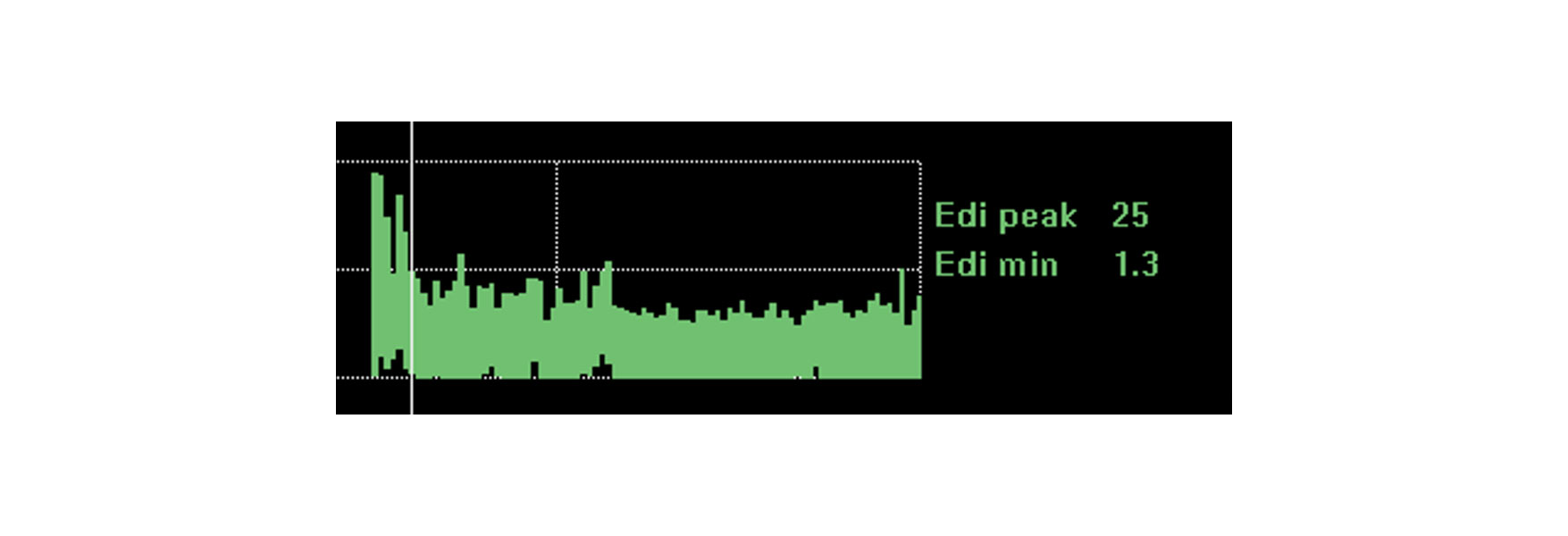
Monitor de impact van interventies, rust en revalidatie en identificeer trends
Het monitoren van de activiteit van het diafragma geeft extra zekerheid dat de patiënt de veranderingen die u doorvoert, aankan. De activiteit van het diafragma wordt beïnvloed door diverse fysiologische veranderingen, zoals rust, rechtop zitten, lopen, cafeïnegebruik en zelfs algehele revalidatie en herstel.
Als de patiënt met deze veranderingen om kan gaan, kan de activiteit van het diafragma onveranderd blijven. Een verslechtering van de klinische situatie en de noodzaak van meer ademhalingsinspanning zullen de activiteit van het diafragma hoogstwaarschijnlijk verhogen. Een verbeterde rustpositie zal de benodigde activiteit van het diafragma voor ademhaling verminderen.
De afbeelding toont de continue diafragma-activiteit van een patiënt die op het punt stond geïntubeerd te worden, vanwege acute ademhalingsmoeilijkheden na een longontsteking. Door de diafragma-activiteit te monitoren, slaagde de arts erin de ondersteuning te optimaliseren en de situatie te verbeteren.
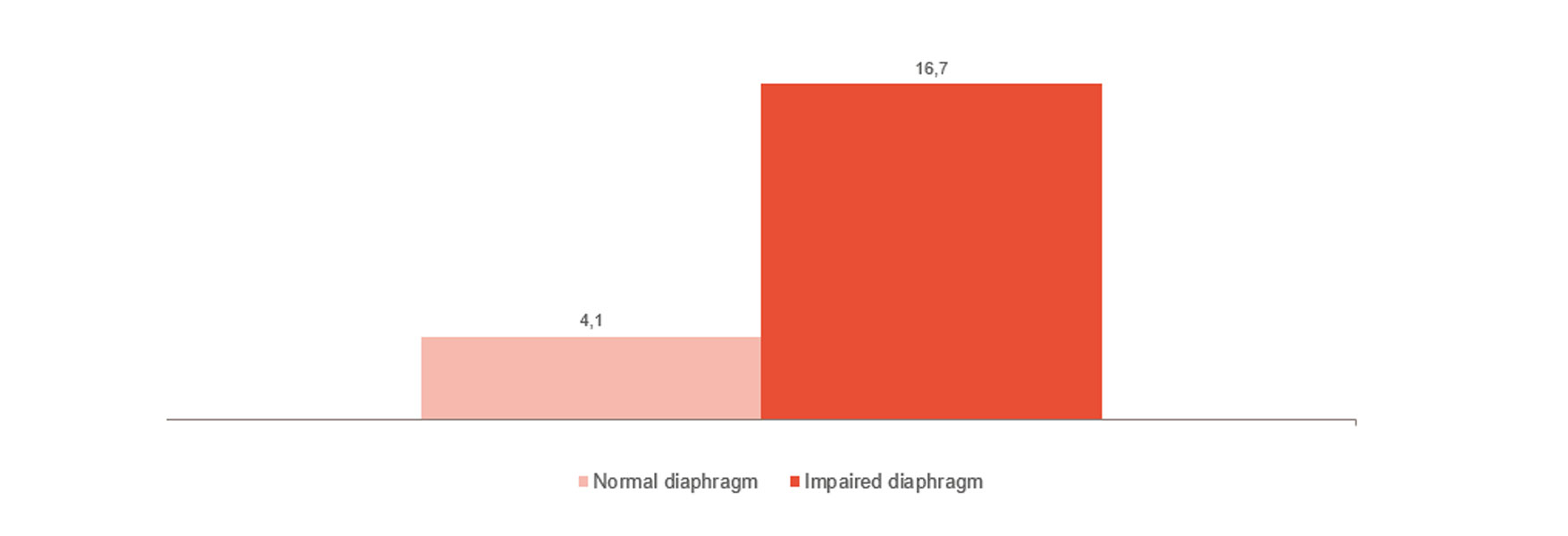
Monitoring en trends bij weanen
Zoals in de afbeelding wordt getoond, is een disfunctie van het diafragma sterk verbonden met problemen bij het weanen.[4] Het monitoren van de diafragma-activiteit kan u helpen te beoordelen of de patiënt klaar is voor het weanen en de voortgang gedurende het gehele behandeltraject te volgen: van invasieve beademing naar non-invasieve beademing, high-flowtherapie en het einde van alle ondersteuning.[24],[25],[26]
Binnen enkele minuten wordt gemeten in welke mate uw patiënt met verminderde ondersteuning om kan gaan. Dit kan u helpen de ondersteuning te verbeteren of bij te sturen. Het kan nodig zijn om terug te keren naar uw vorige instellingen om te voorkomen dat uw patiënt terugvalt en last krijgt van de complicaties die daar vaak mee gepaard.
