¿Qué es la anestesia de flujo bajo?
En la anestesia de bajo flujo, un sistema de reinspiración utiliza un flujo de gas fresco (FGF) inferior a la ventilación minuto del paciente. Este enfoque permite que una parte significativa de los gases exhalados, excepto el dióxido de carbono (que se absorbe), sean reinspirados por el paciente.
El flujo bajo se caracteriza generalmente por un FGF inferior a 1,0 l/min. Existen varias gradaciones dentro del espectro del FGF, como el flujo bajo, el flujo mínimo o el flujo metabólico, que se refieren a una reducción aún mayor del FGF. Para el Dr. Jan Hendrickx, anestesista del Hospital OLV de Aalst, Bélgica, estos términos históricos se refieren solo a tres puntos de todo el espectro de FGF: 1, 0,5 y 0,2 l/min, respectivamente: «Aunque estos términos se utilizan ampliamente, es más preciso hacer referencia al FGF específico que se utiliza. Un término que está ganando popularidad, anestesia de flujo bajo, hace hincapié en la adaptación a un FGF inferior al que se utiliza actualmente. En lugar de ceñirse a una definición estricta del FGF, se trata de evolucionar la práctica hasta el nivel más bajo de FGF con el que uno se sienta cómodo trabajando. Este flujo bajo controlado por objetivos hace que las distinciones tradicionales de flujo sean algo arbitrarias».
Descubriendo los múltiples beneficios
La anestesia de flujo bajo emite menos gas a la atmósfera y mejora la composición del aire inhalado:
- Beneficios medioambientales: reducción de la contaminación y los residuos
Todos los gases anestésicos actúan como gases de efecto invernadero y, en última instancia, se liberan a la atmósfera. Algunos anestésicos halogenados tienen un potencial de calentamiento global hasta 7020 veces superior al delCO2[1], siendo el desflurano el más impactante. La anestesia de flujo bajo es un limitador de la liberación de estos agentes al medio ambiente. El Dr. Hendrickx destaca la reducción del desperdicio de anestésicos inhalados como una ventaja significativa de la anestesia de flujo bajo, afirmando que «el sistema de respiración circular empleado con flujo bajo actúa esencialmente como un sistema de reciclaje». En consonancia con esto, recomienda minimizar el uso de los vapores y gases más nocivos, como el desflurano, para minimizar el impacto medioambiental de los anestésicos inhalados en los hospitales. - Beneficios pulmonares: conservación del calor y la humedad
Una ventaja añadida es el aumento de la temperatura y la humedad de los gases, normalmente fríos y secos, que entran en el sistema de respiración circular desde las salidas de la pared del quirófano. Cuanto menor es el FGF, másCO2 se procesa a través del absorbedor, lo que da lugar a una mayor producción deH2Oy calor. Esta optimización aumenta la limpieza mucociliar, estabiliza la temperatura corporal, disminuye la pérdida de agua y aumenta tanto la comodidad como la seguridad del paciente[2]. - Ventajas económicas: reducción de costes
El coste de los agentes anestésicos puede constituir una parte significativa del gasto total de los equipos de anestesia, dependiendo del FGF. La disminución del consumo de agente tiene implicaciones económicas positivas para las instituciones sanitarias. - Beneficios educativos: mayor comprensión de la farmacocinética
Prestar más atención y ser más observador contribuye a una comprensión más profunda de la farmacocinética, lo que supone una ventaja fundamental de la anestesia de flujo bajo. - Beneficios de seguridad para el personal del quirófano: fugas minimizadas
Al reducir el exceso de gas liberado al medio ambiente, la concentración de gas anestésico en los quirófanos disminuye significativamente. Esto reduce los riesgos laborales para el personal de quirófanos.
Cabe destacar que las ventajas de utilizar un sistema de reinspiración durante la anestesia se conocen desde 1924, lo que subraya su valor perdurable durante casi un siglo[3].
Retos de la anestesia manual de flujo bajo
Para un control manual seguro durante la entrega, es esencial comprender las diferencias entre el FGF, la ventilación minuto, la concentración administrada y la concentración inspirada, así como utilizar un analizador de gases. El incumplimiento de estos principios puede provocar una sobredosis o una dosis insuficiente de anestésico, lo que puede dar lugar a hipotensión y conciencia del paciente, así como a una dosis insuficientede O2, lo que produce mezclas hipóxicas inspiradas. El Dr. Hendrickx señala que esta es la razón por la que el flujo bajo controlado manualmente se percibe a menudo como difícil o arriesgado en la práctica:
- Difícil: la reducción del flujo de gas fresco aumenta la diferencia entre la concentración preestablecida suministrada y la realmente inspirada por el paciente. Cuanto menor es el FGF, más pronunciada es esta diferencia. Esto puede dar una sensación de pérdida de control, ya que lo que se «suministra» no equivale a «lo que recibe el paciente».
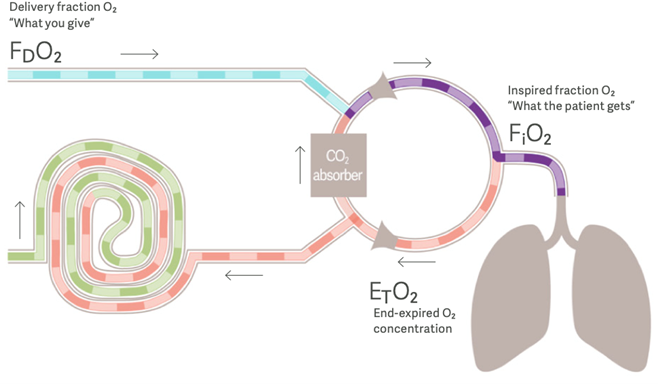
- Inseguro: uno de los riesgos más importantes del uso de la anestesia de flujo bajo es la formación de mezclas hipóxicas. La reducción del flujo de gas fresco en un sistema de reinhalación puede diluirel O2 inspirado durante la reinhalación (fig. 1). Como resultado, el oxígeno inspirado puede caer por debajo de la fracción suministrada. Si esta discrepancia no se reconoce y se aborda rápidamente, pueden aparecer mezclas hipóxicas.
- Engorroso: «Reducir el FGF en los anestésicos inhalados puede provocar discrepancias entre las concentraciones suministradas e inspiradas, inducir un lavado más lento, requerir ajustes más frecuentes del vaporizador, dificultar la predicción de los ajustes para cada paciente y provocar oscilaciones en la concentración objetivo del agente al final de la espiración. Este efecto se intensifica a medida que disminuye el FGF», afirma el Dr. Hendrickx. Se requieren ajustes manuales continuos, lo que podría elevar el riesgo de niveles inadecuados de gas anestésico y una profundidad de anestesia insuficiente. «Las enseñanzas tradicionales tienden a dar demasiada importancia a las matemáticas, pero el flujo bajo es sencillo. No se requieren matemáticas avanzadas para aplicar estos principios tanto a los agentes inhalados comoal O2».
«La anestesia de flujo bajo controlada por objetivos en un sistema de circuito cerrado resuelve todos los problemas anteriores», afirma el Dr. Hendrickx. «En lugar de controlar manualmente los medidores de flujo y los vaporizadores, ahora los médicos dan instrucciones a la estación de trabajo de anestesia equipada con un Control de gas automático (AGC) para que mantenga concentraciones específicas de anestésico y O₂ al final de la espiración. La estación de trabajo ajusta automáticamente la configuración del medidor de flujo y del vaporizador para alcanzar esas concentraciones objetivo, lo que ayuda a los médicos a hacer un gran trabajo a la hora de minimizar el FGF y, por lo tanto, el desperdicio[4]».
El AGC facilita el control de la entrega de oxígeno mediante un único ajuste objetivode FIO₂ . Este ajuste tiene prioridad y no se ve afectado por la selección de la velocidad del agente anestésico, lo que reduce el riesgo de hipoxia. Permite adaptar la administración del agente al estado del paciente o al tiempo de incisión quirúrgica y minimiza el riesgo de sobredosis o subdosificación. Una herramienta de control de velocidad y predicción en tiempo real permite a los médicos determinar el tiempo hasta el objetivo de fin de espiración, lo que mejora la eficiencia de la entrega de gas. Los efectos positivos de AGC están bien respaldados tanto por la evidencia como por el consenso de los expertos[4],[5].
AGC: una inversión inteligente en sostenibilidad
La tecnología AGC permite una reducción segura y significativa de los residuos anestésicos, reduciéndolos hasta en un 58 %[5]. «La seguridad del paciente no tiene precio, y la protección del medio ambiente es fundamental. Aunque el flujo bajo reduce el consumo de agente inhalado, también aumenta el uso del absorbedor de CO₂, pero todos mis análisis hasta ahora sugieren que el efecto combinado es una disminución de los costes y la contaminación», afirma el Dr. Hendrickx. Existen modelos personalizados para calcular estos datos en escenarios específicos.
Los equipos de anestesia Flow de Getinge ofrecen las ventajas de la anestesia de flujo bajo sin sus inconvenientes. Equipados con AGC, tecnología Volume Reflector y un vaporizador con tecnología de inyector de combustible, estos equipos permiten a los médicos aplicar de forma segura la anestesia a bajos flujos, reduciendo las emisiones de gases anestésicos y minimizando los costes[4]. En caso de que los niveles de oxígeno caigan por debajo del 21 %, sin intervención del médico, el O₂Guard, el único protector hipóxico activo disponible en el mercado, interviene para evitar la entrega de mezclas hipóxicas, lo que ayuda a minimizar el riesgo de hipoxia[6],[7].
La anestesia de flujo bajo ofrece una serie de ventajas, que abarcan desde aspectos medioambientales hasta económicos. Sin embargo, sus retos a menudo han disuadido a los profesionales. Ahora, los innovadores sistemas automatizados están transformando esta práctica, permitiendo a los médicos aprovechar sus ventajas y sortear sus complejidades sin problemas.