Как мониторинг диафрагмы помогает повысить эффективность искусственной вентиляции легких?
Респираторная поддержка — это реанимационное вмешательство, проводимое в ОРИТ, но при отсутствии правильного баланса она также повышает риск неблагоприятного исхода лечения [1], [2]. Именно в таких случаях помогает мониторинг диафрагмы, поскольку он является маркером таких исходов, как больничная смертность и длительное отлучение от ИВЛ. Более того, он помогает принимать более информированные решения в ходе респираторной терапии.
Клиническое значение повреждения диафрагмы
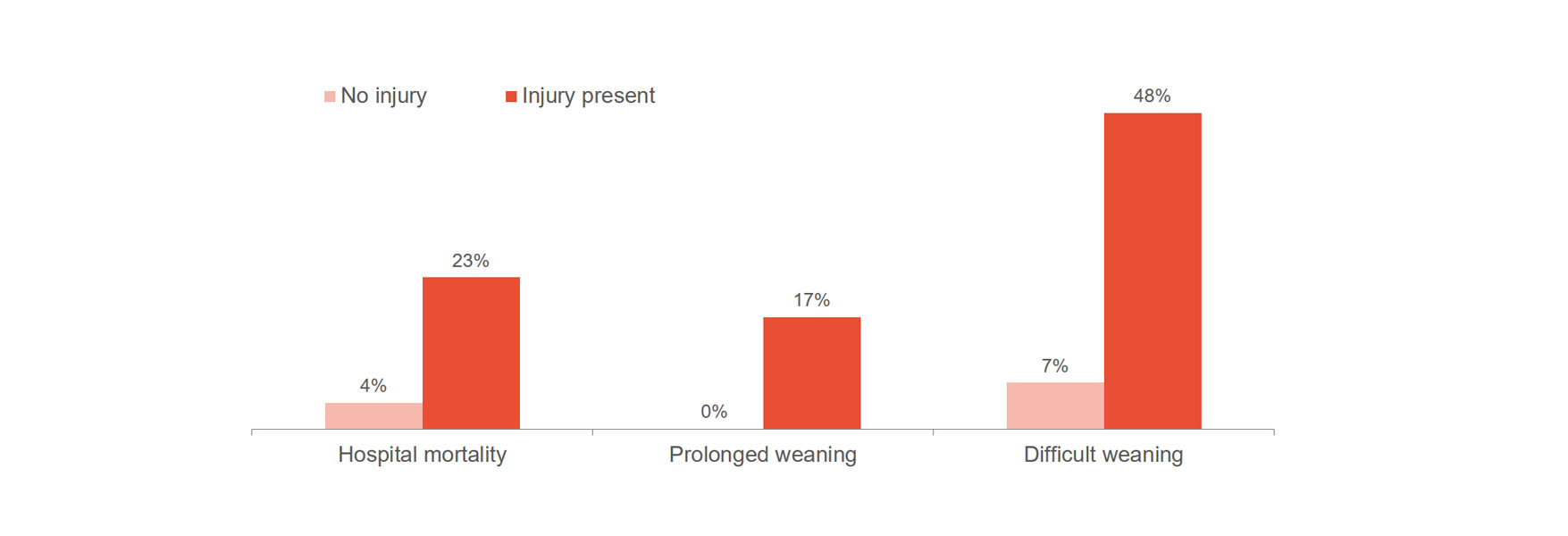
Повреждение диафрагмы значительно повышает риск ухудшения результатов лечения — например, затрудняет отлучение от ИВЛ или делает этот процесс более длительным, — а также способствует росту больничной летальности [1],[2]. Важно отметить, что у 23–84% пациентов отмечаются значительные повреждения диафрагмы при первой попытке спонтанного дыхания [3]. В одном исследовании было установлено, что среднее время пребывания на ИВЛ составляет 576 часов для пациентов с повреждением диафрагмы в сравнении с 203 часами для пациентов без него [4].
Считается, что основные причины обусловлены двумя факторами [1]. В некоторых случаях пациенты затрачивают на дыхание слишком много усилий, что приводит к утолщению диафрагмы, а в других случаях пациенты затрачивают слишком мало усилий после избыточной поддержки и (или) управляемой вентиляции на раннем этапе лечения, что приводит к атрофии. И те, и другие изменения ухудшают результат лечения. Дополнительные сложности создает то, что стандартные диагностические средства аппаратов ИВЛ не позволяют получить данную информацию.
Почему имеющихся средств диагностики в аппарате ИВЛ недостаточно?
Кривые вентиляции используются для интерпретации дыхательных потребностей пациента, но их основная функция заключается в том, чтобы показать, какая помощь оказывается пациенту. Это затрудняет обнаружение асинхронности, избыточного седативного эффекта, а также избыточной или недостаточной поддержки при самостоятельном дыхании.
Например, лишь 21 % врачей обнаруживают асинхронность в виде пропущенных попыток вдоха [5]. Кроме того, может показаться, что вентиляция с поддержкой давлением инициирует спонтанное дыхание, хотя в действительности это не так [5], [6].
Результатом является неопределенность в отношении того, сколько дыхательных усилий прилагает пациент и в какой степени он подвержен риску повреждения диафрагмы.
Как осуществлять мониторинг диафрагмы?
Чтобы попытаться защитить диафрагму, необходимо диагностировать ее потенциальные повреждения и контролировать ее непрерывную активность.
Ультразвуковой контроль помогает оценить дисфункцию диафрагмы путем измерения ее толщины и потенциальных изменений толщины с течением времени. Последние достижения в сфере ультразвуковой визуализации позволяют врачам выполнять более реалистичную оценку функционирования диафрагмы и потенциально защищать диафрагму во время искусственной вентиляции легких [7].
Для непрерывного, вдох за вдохом, мониторинга работы диафрагмы используется измерение электрической активности диафрагмы (Edi). Это диагностический инструмент у кровати пациента, функционирующий через специальную подающую трубку. Сигнал напряжения отображается в виде кривой в сочетании с обычными кривыми давления/потока у пациента и показывает наличие, отсутствие и форму дыхания.
Метод Edi помогает понять, как работает дыхание, определить асинхронность и оценить уровень влияния избыточной или недостаточной поддержки и седации на способность к дыханию [8], [9]. Также можно обнаруживать изменения усилий после вмешательств. Примерами могут служить изменение положения пациента, введение лекарственных препаратов, таких как сальбутамол, или, что особенно важно, уменьшение вспомогательной искусственной вентиляции легких во время отлучения от ИВЛ.
Возможно, для получения полной картины потребуется комбинация УЗ-мониторинга и непрерывного мониторинга диафрагмы (Edi).
Как мониторинг диафрагмы помогает защитить пациента и упростить отлучение от ИВЛ?
Во избежание повреждения легких, связанного с аппаратом ИВЛ, старайтесь избегать инвазивной вентиляции, асинхронности, избыточной и недостаточной поддержки, а также длительных периодов седации и отсутствия активности диафрагмы. В «борьбе» пациентов с аппаратом ИВЛ первые часто терпят поражение. Результатом, как правило, является усиление седации, более длительное пребывание на ИВЛ и, возможно, интубация.
Мониторинг диафрагмы помогает справиться с этими проблемами [10], [11], [12]. Он позволяет увидеть усилия, прилагаемые пациентом при каждом вдохе. Кроме того, вы можете видеть, отвечает ли аппарат ИВЛ своевременно надлежащей поддержкой, поскольку у вас есть объективная физиологическая информация.
При неинвазивной терапии это помогает адаптировать временные параметры и уровень поддержки аппарата ИВЛ, что может снизить потребность в интубации. Хорошее взаимодействие пациента и аппарата ИВЛ является одним из ключевых факторов успешной НИВ [13].
Непрерывный мониторинг также может служить индикатором дыхательных усилий в режиме реального времени, помогая понять, когда действительно необходима интубация. Он даже помогает оптимизировать хронометраж попыток спонтанного дыхания, а также сделать их более успешными и частыми.
Как мониторинг диафрагмы помогает уменьшить время пребывания на аппарате ИВЛ?
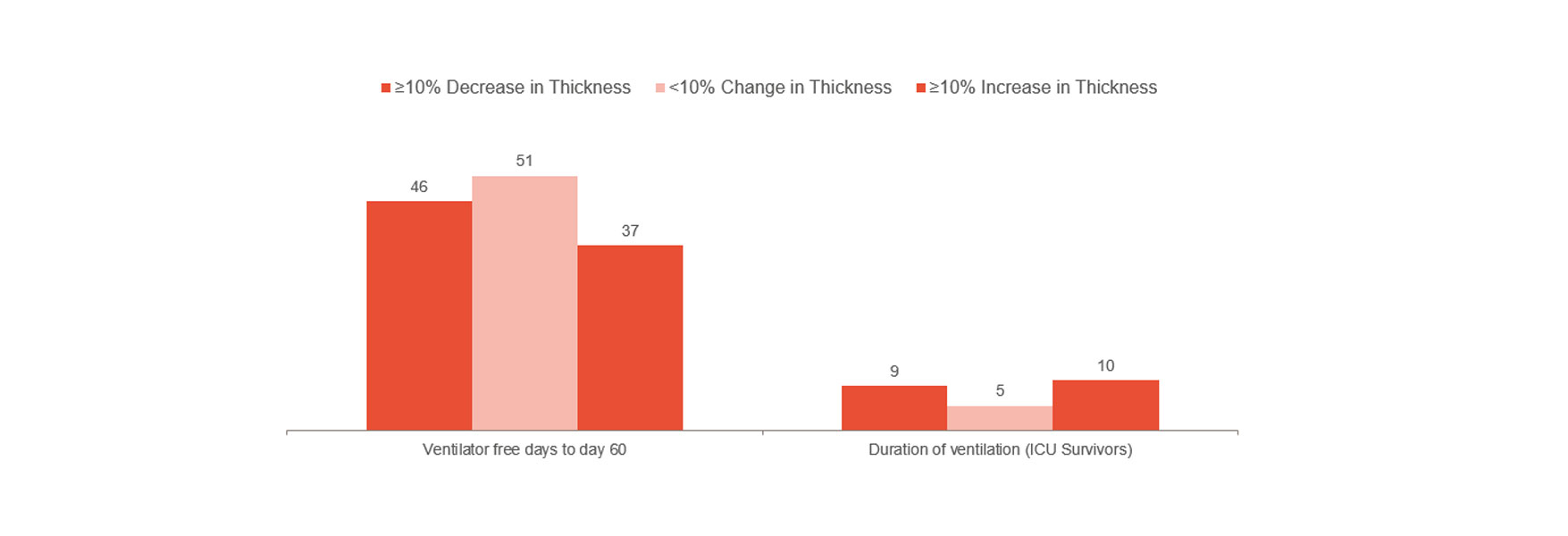
Голигер (Goligher) показал, что первые признаки изменения толщины диафрагмы являются маркером длительности пребывания в ОРИТ, а также развития других осложнений, таких как необходимость в повторной интубации и трахеостомии, длительная искусственная вентиляция легких и летальный исход [1]. Это указывает на то, что оптимальной стратегией является сохранение доли утолщений на уровне не более 10–20 %. Таким образом, этот параметр может сигнализировать о риске для пациента и помочь оптимизировать лечение. Для более глубокого понимания того, позволяет ли профилактика повреждения диафрагмы предотвратить осложнения, требуются рандомизированные клинические испытания.
Однако клинический опыт Лондонской больницы, показавший значительное сокращение времени, проводимого на ИВЛ, при мониторинге активности диафрагмы, согласуется с приведенной выше информацией [14]. В группе, находившейся на ИВЛ без мониторинга, медианное время пребывания на ИВЛ составило 12 дней, в противовес 9 дням в группе с мониторингом, в которую входили 103 пациента из 493.
Мониторинг диафрагмы также помогает обнаруживать нарушения, такие как врожденный синдром центральной гиповентиляции и повреждение диафрагмального нерва [15], [16].
Как мониторинг диафрагмы помогает принимать более информированные решения по лечению?
Мониторинг активности диафрагмы помогает принимать более информированные решения для пациента на протяжении всего периода лечения и дает ценную информацию на разных этапах принятия решений.
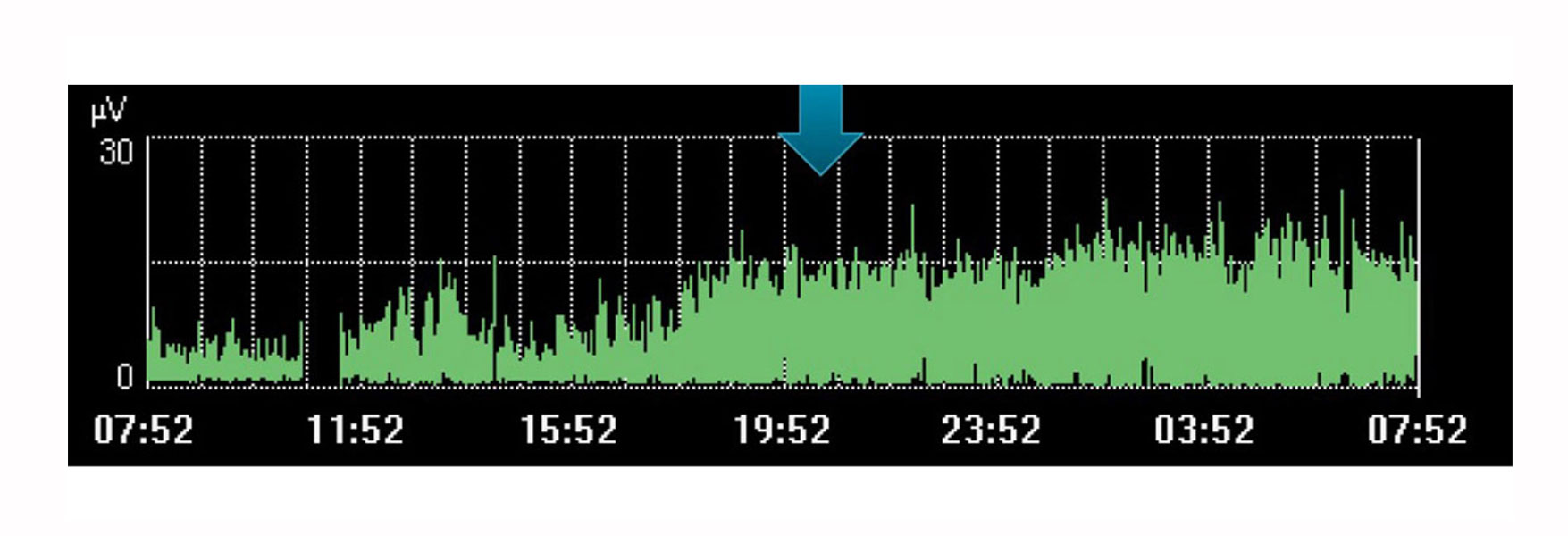
Мониторинг и выявление тенденций в дыхательной деятельности
По последним данным, мониторинг диафрагмы с использованием Edi может применяться для мониторинга дыхательных усилий и взаимодействия пациента с аппаратом ИВЛ [18].
Конечно же, возможности применения мониторинга Edi как единственного, отдельно взятого показателя ограничены. Подобно другим физиологическим показателям, его следует рассматривать в сочетании с другими измерениями, а также в контексте изменений терапии — тенденции в изменении показаний с течением времени могут помочь определить, движется ли пациент в нужном направлении.
Например, на изображении выше показана активизация усилий диафрагмы в период, когда врач планировал для пациента отдых. Данная тенденция указывает на то, что отдыха не произошло, поскольку в течение этого времени пациент затратил больше усилий.
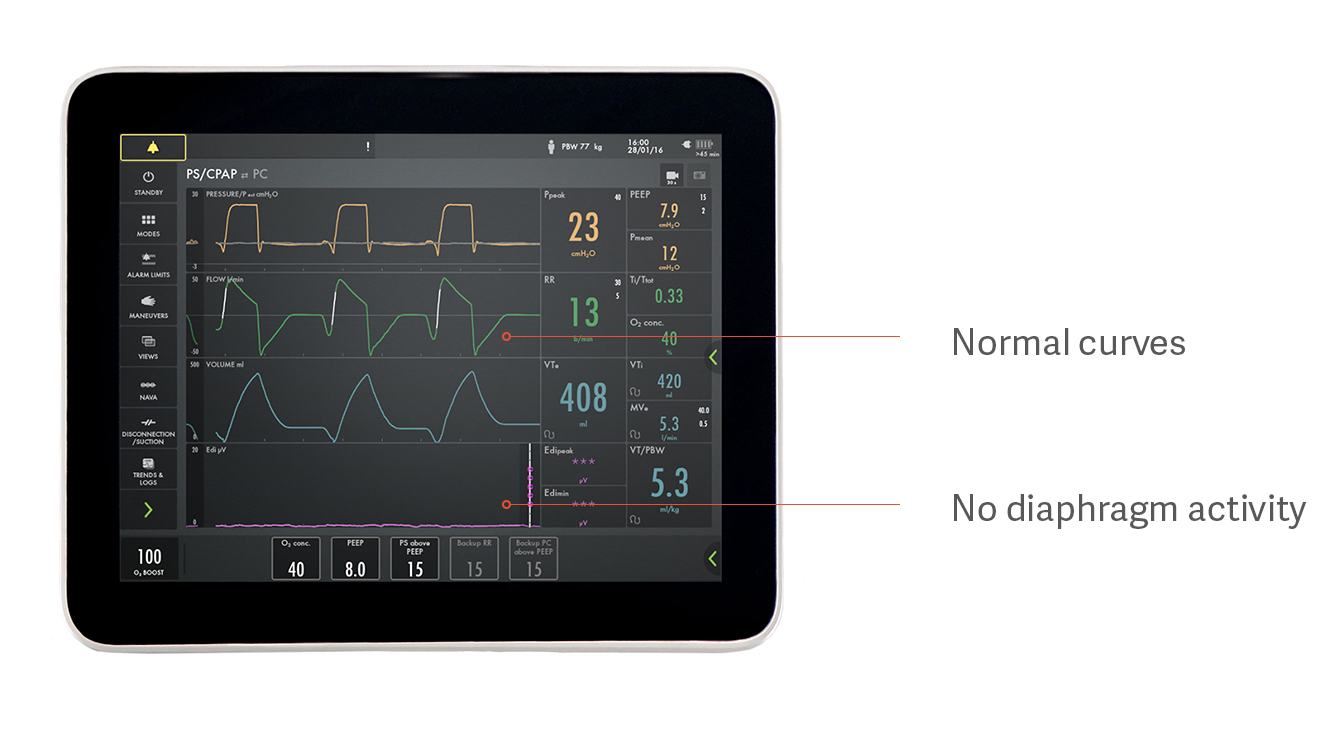
Определение избыточной поддержки и недостаточной поддержки
Чтобы не допустить повреждения диафрагмы у пациента, она должна иметь надлежащий уровень активности. Это сложно понять без мониторинга диафрагмы.
Например, может создаться впечатление, что пациент способен спонтанно дышать при поддержке давлением, но на самом деле он вообще не использует диафрагму, как показано на рисунке выше. Это один из примеров того, как избыточная поддержка не позволяет диафрагме работать, что приводит к ее атрофии. Кривые давления, потока и объема выглядят нормальными, но пурпурный Edi-сигнал внизу ровный, что указывает на неактивную диафрагму.
Другой пример — недостаточная поддержка, которая является противоположностью избыточной и в той же степени вредна для пациента. Пациент с недостаточной поддержкой тратит на дыхание слишком много сил, что приводит к утолщению диафрагмы. Это, вероятно, легче увидеть у пациента, но без объективного показателя на аппарате ИВЛ сложно говорить об этом с уверенностью.
Оба примера повреждений диафрагмы (атрофия и утолщение) часто наблюдаются у пациентов и ассоциируются с ухудшением клинических показателей [1].
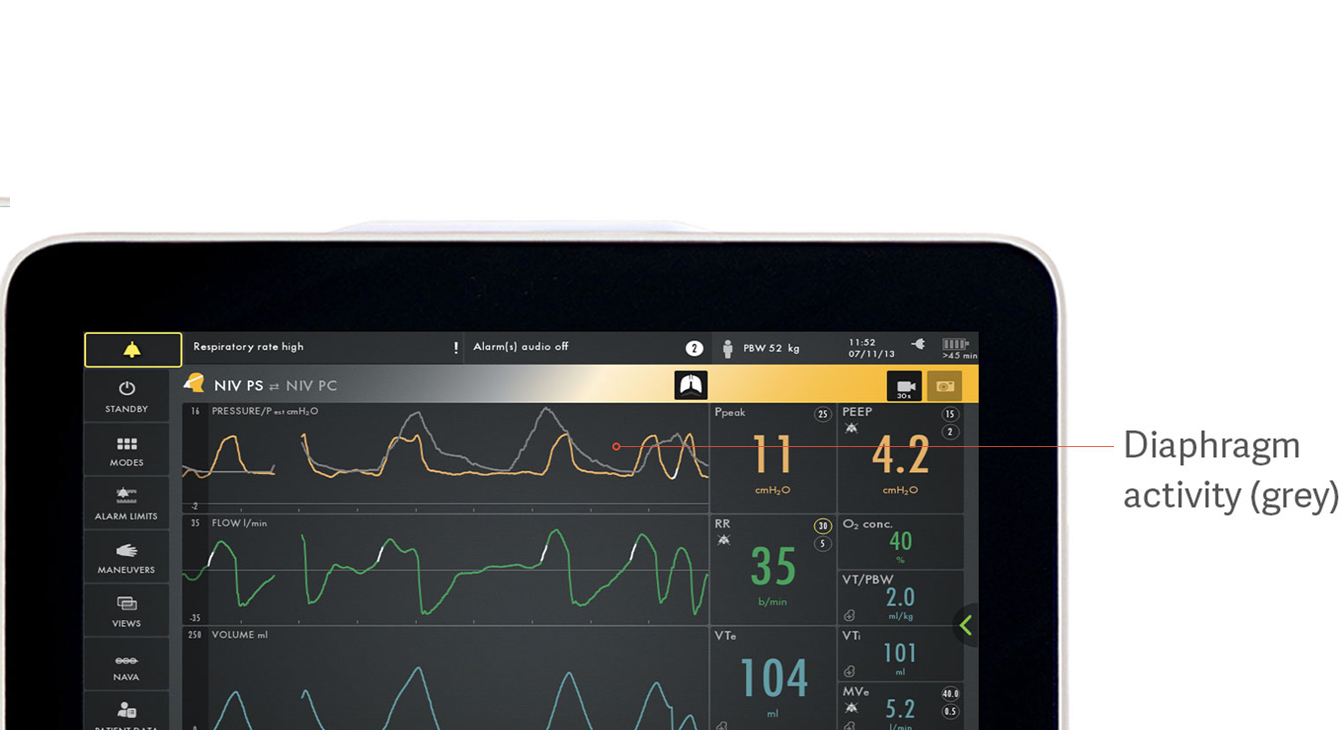
Определение асинхронности пациента и аппарата ИВЛ
Асинхронность ассоциируется с ухудшением клинических показателей во время искусственной вентиляции легких [18]. В недавнем исследовании лишь 21 % врачей смогли определить асинхронность в виде пропущенных попыток вдоха [5]. Существует множество других типов асинхронности, которые легко не заметить: неэффективные или избыточные усилия, задержки при попытке вдоха, задержка циклического выключения, двойное триггирование и автоматическое триггирование.
На рисунке показано, как электрическая активность диафрагмы, показанная серым цветом, накладывается на кривую давления (желтая), что облегчает наблюдение за различиями между тем, что нужно пациенту, и тем, что дает аппарат ИВЛ.
Определение режима вентиляции
Цель должна заключаться в том, чтобы пациент мог сохранять оптимальные дыхательные усилия, которые не являются слишком сильными или слишком слабыми [1]. Постоянно осуществляя мониторинг активности диафрагмы, вы можете определить уровень усилий пациента в конкретный момент времени (если они есть). Если активность диафрагмы высокая и продолжает повышаться, возможно, необходимо повысить уровень поддержки [19], [20], [21].
Если активность низкая или снижается, возможно, уровень поддержки можно уменьшить [19]. Перед изменением уровня поддержки также важно проконтролировать другие диагностические параметры, связанные с вентиляцией. Объем исследований в этой области растет. В будущем, возможно, более подробная информация о параметрах диафрагмы позволит еще больше повысить качество оценки [22].
Задание оптимального ПДКВ
Стандартизированного способа настройки ПДКВ для пациента при спонтанном дыхании не существует. При этом правильно установленное ПДКВ может уменьшить степень ателектаза, циклическое открытие и закрытие дыхательных путей, а также защитить альвеолы. Это, в свою очередь, оптимизирует легочную механику и повышает оксигенацию.
Титрование ПДКВ с мониторингом диафрагмы продемонстрировало определенные результаты у новорожденных, позволяя ребенку надлежащим образом расслабляться между вдохами и предотвращая спадение легких [12].
У взрослых пациентов Пассат (Passath) использовал мониторинг диафрагмы и кислорода во время изменений ПДКВ для определения уровня ПДКВ, при котором приливное дыхание происходит с минимальными усилиями [23]. Чрезмерное снижение ПДКВ приводило к увеличению дыхательных усилий на 50–60 %, что в сочетании со снижением концентрации кислорода также позволяло предположить частичное спадение легких.
Оптимизация контроля седации
Главное преимущество мониторинга активности диафрагмы применительно к седации — это попытка поддерживать диафрагму в активном состоянии как можно дольше [1]. Просто ведите мониторинг активности диафрагмы пациента и контролируйте реакцию на вентиляцию, чтобы определить надлежащий уровень седации с устойчивой активностью диафрагмы.
Может потребоваться некоторая подготовка, чтобы отличить эффект седации от других физиологических факторов, которые могут повлиять на работу диафрагмы, однако Edi особенно эффективен во время седативных процедур, поскольку можно непрерывно видеть изменения усилий пациента.
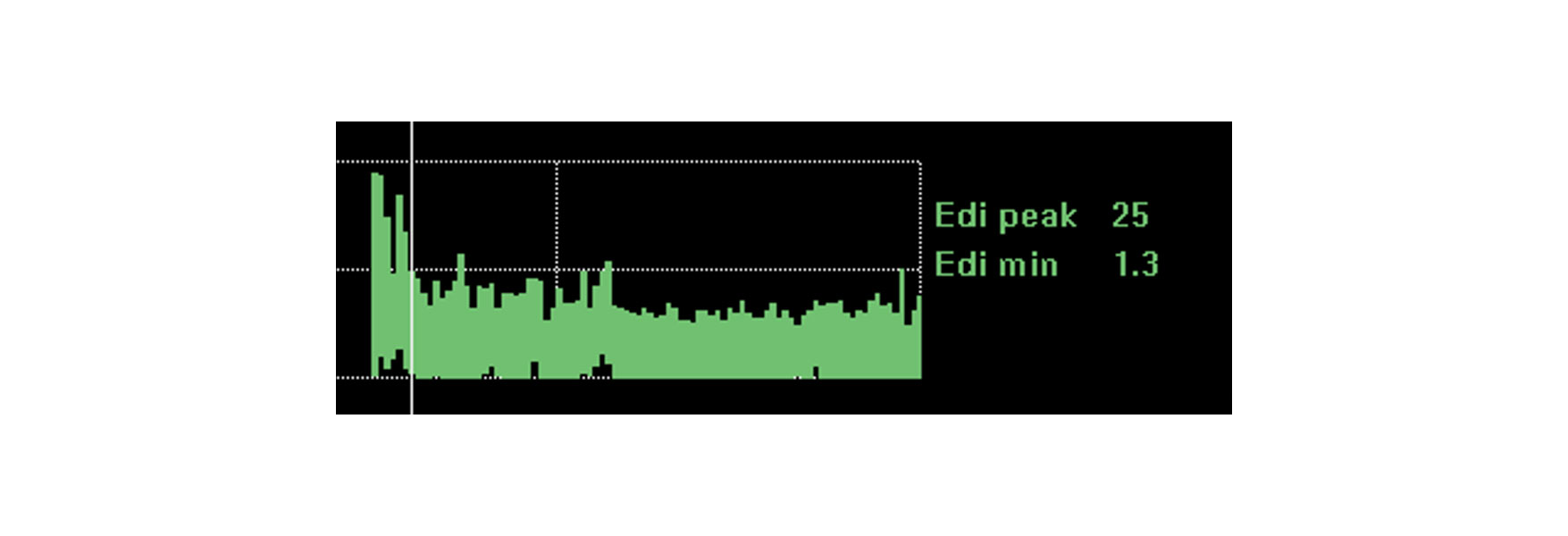
Выявление тенденций и мониторинг влияния вмешательств, отдыха и реабилитации
Мониторинг активности диафрагмы дает дополнительную уверенность в том, что пациент сможет справиться с изменениями. На активность диафрагмы влияет ряд физиологических изменений, таких как отдых, сидячее положение, ходьба, лечение кофеином и даже общая реабилитация и восстановление.
Если пациент справляется с этими изменениями, то активность диафрагмы может в значительной степени оставаться неизменной. Ухудшение клинической ситуации и необходимость в более интенсивной дыхательной работе, вероятнее всего, повысят активность диафрагмы. Улучшенное положение покоя снизит активность диафрагмы, необходимую для дыхательных движений.
На изображении показана непрерывная активность диафрагмы пациента, которого собираются интубировать из-за развития острого респираторного дистресс-синдрома вследствие пневмонии. Благодаря мониторингу активности диафрагмы врачу удалось оптимизировать поддержку и кардинально изменить ситуацию.
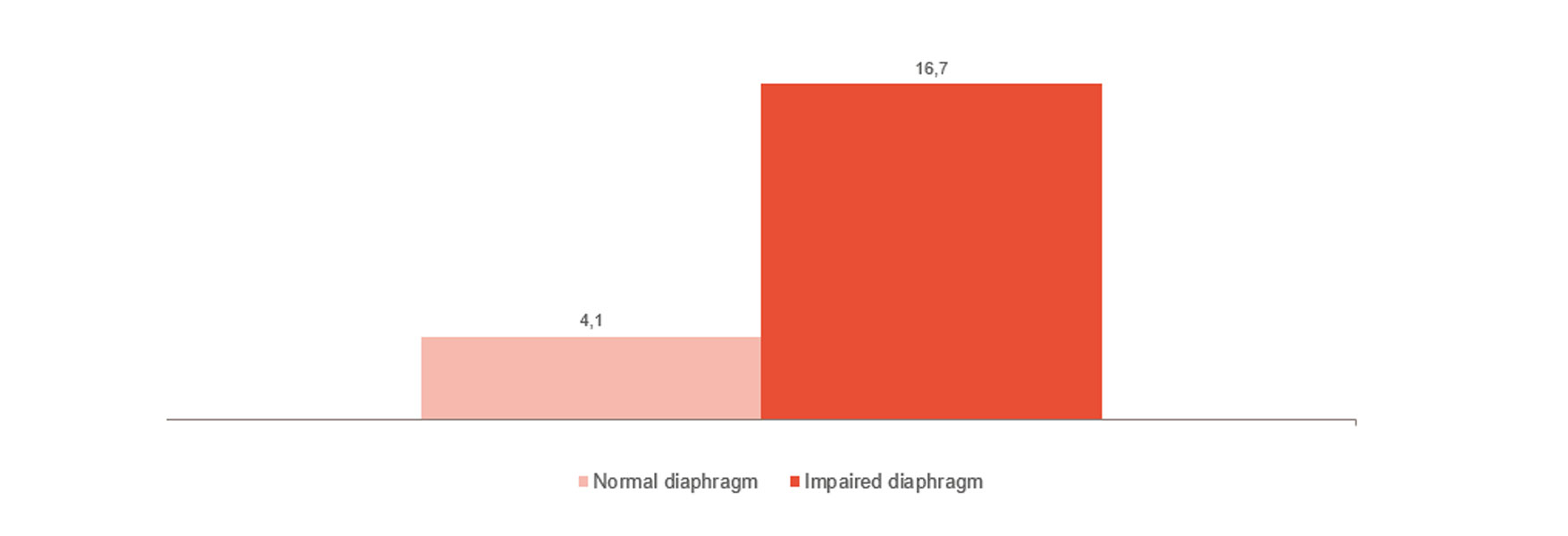
Мониторинг и определение тенденций при отлучении от ИВЛ
Как показано на рисунке, дисфункция диафрагмы тесно связана со сложностями при отлучении от аппарата ИВЛ [4]. Мониторинг активности диафрагмы помогает спрогнозировать готовность пациента к отлучению от аппарата ИВЛ и проконтролировать этот процесс [24], [25], [26] на всех этапах — от инвазивной вентиляции до неинвазивной вентиляции, вентиляции с высоким потоком и отказа от поддержки вообще.
Способность пациента справляться с меньшей поддержкой определяется за считаные минуты, что помогает наращивать или регулировать поддержку. Может потребоваться вернуться к предыдущим настройкам, чтобы предотвратить распространенные рецидивы и осложнения.
