Mitigación del riesgo de daños durante la transición de la ventilación mecánica controlada a la asistida
La monitorización de la fuerza del esfuerzo respiratorio del paciente, la valoración de la sedación y la selección del régimen de ventilación correcto son vitales cuando se pasa de la ventilación controlada a la asistida.
Para guiarnos hacia el destete de los pacientes, utilizando técnicas de monitorización con ventilación de protección pulmonar y de diafragma personalizadas, contamos con la Dra. Irene Telias, una de las mayores expertas del mundo médico en fisiología respiratoria.
Aprendizajes clave en este artículo.
- Evitar esfuerzos potencialmente perjudiciales
- Abordar la sedación excesiva, la asincronía, la atrofia del diafragma, los esfuerzos respiratorios excesivamente altos o bajos, la asistencia excesiva y mucho más
- Técnicas de monitorización y sus beneficios y limitaciones
- Regímenes de ventilación beneficiosos durante la transición
Salva vidas, pero puede ser perjudicial
La ventilación mecánica es una intervención que se utiliza habitualmente en pacientes adultos en estado extremadamente crítico que requieren soporte respiratorio o protección de las vías respiratorias. El ventilador facilita el intercambio de gases mientras se utilizan otros tratamientos para mejorar la condición clínica del paciente. A pesar de ser una medida que salva vidas, la ventilación mecánica puede ser potencialmente perjudicial para los pacientes y, por lo tanto, una gestión cuidadosa de los ajustes del ventilador y de los fármacos empleados durante la ventilación mecánica son factores clave para evitar daños.
Evaluación de la transición de ventilación totalmente controlada a asistida
Uno de los principales problemas de la ventilación mecánica es la transición de la ventilación mecánica totalmente controlada a la asistida, que debe lograrse lo antes posible para mejorar los resultados del paciente. Sin embargo, esta transición debe realizarse de forma que se evite el empeoramiento de los problemas respiratorios del paciente, lo que obligaría al equipo de la UCI a reanudar la ventilación totalmente controlada.
Para distinguir entre respiraciones sin músculos respiratorios activos (ventilación totalmente controlada) y respiraciones con músculos activos (ventilación asistida), necesitamos monitorizar el esfuerzo respiratorio del paciente. La Dra. Irene Telias formó parte del programa de subespecialización de Toronto de 2015 a 2017, inicialmente como becaria del programa de subespecialización y, después, como investigadora y becaria. Ahora está en Toronto estudiando un doctorado en fisiología respiratoria aplicada en la Universidad de Toronto.
Irene es una de las expertas más importantes del mundo médico en fisiología respiratoria, más concretamente en esfuerzo respiratorio durante la ventilación mecánica en cuidados intensivos (UCI) y su influencia en las lesiones pulmonares inducidas por la ventilación y la disfunción diafragmática. Al evaluar la transición de la ventilación mecánica totalmente controlada a la asistida, Irene siempre utiliza técnicas de monitorización para valorar la ventilación mecánica y la sedación con el fin de evitar un esfuerzo potencialmente perjudicial. «Un rango intermedio de esfuerzo inspiratorio se asocia con mejores resultados para los pacientes y podría ser un objetivo razonable para la mayoría de los pacientes», afirma Irene.
Un rango intermedio de esfuerzo inspiratorio se asocia con mejores resultados para los pacientes y podría ser un objetivo razonable para la mayoría de los pacientes.

Evaluar los desafíos de la transición
La transición de la sedación completa y la ventilación controlada a la respiración espontánea siempre es muy difícil, afirma. «¿Por qué? En primer lugar, el paciente solo está parcialmente consciente de lo que está sucediendo y normalmente experimenta una fuerte incomodidad con un tubo en la garganta», afirma Irene.
En segundo lugar, bajo sedación hay muchos estímulos que indican al cerebro que respire con fuerza. Normalmente, los pacientes siguen estando muy enfermos. Por ejemplo, la inflamación sistémica debida a una infección nueva o no resuelta es un fuerte estímulo directo para que el paciente respire. «Debido a que el paciente está respirando y el ventilador proporciona soporte al mismo tiempo durante este periodo crítico, es fundamental sincronizar el patrón respiratorio del paciente y la de la insuflación y exhalación del ventilador. Si hay una falta de sincronía entre ellos, se produce una asincronía paciente-ventilador, un fenómeno que se asocia con un aumento de la mortalidad de los pacientes», explica Irene.
Irene continúa: «Esta asincronía paciente-ventilador puede ser muy incómoda para el paciente y potencialmente perjudicial para los pulmones y el músculo respiratorio principal del paciente, el diafragma». ¿Cómo se abordan estos retos? ¿Cómo pueden los médicos adaptar o adecuar la ventilación mecánica para evitar daños al paciente en el proceso de transición de la ventilación totalmente controlada a la ventilación asistida?
Al evaluar la transición de la ventilación mecánica totalmente controlada a la asistida, Irene siempre utiliza técnicas de monitorización para valorar la ventilación mecánica y la sedación con el fin de evitar un esfuerzo potencialmente perjudicial.
Personalización de la ventilación mecánica y la sedación
Según Irene, los estudios han demostrado que los pacientes con una gama intermedia de esfuerzos inspiratorios (ni excesivos ni demasiado superficiales) tienen mejores resultados en la UCI, incluidas tasas de mortalidad más bajas. No obstante, un único tamaño no sirve para todos y es necesario personalizar el tratamiento. «Existen varias formas importantes de personalizar la atención al paciente para aumentar las posibilidades de una gama intermedia de esfuerzos inspiratorios», afirma Irene. «En primer lugar, el régimen de ventilación mecánica que utilizamos es importante, así como la cantidad de soporte que ofrece el ventilador y cómo adaptamos el patrón respiratorio proporcionado por el ventilador de acuerdo con el patrón respiratorio del paciente para que este respire en sincronía con el ventilador mientras el ventilador ofrece soporte. Ese es uno de los elementos de esta estrategia de ventilación que protege los pulmones y el diafragma: gestionar la configuración del ventilador».
La segunda parte del proceso de personalización del paciente es el uso de la sedación para modular la actividad respiratoria. Los agentes sedantes más utilizados para hacerlo son el propofol y las benzodiazepinas. «Sin embargo, los médicos tienen que valorar estos fármacos con cuidado», indica Irene, «porque si se usan cantidades excesivas, se pueden generar efectos adversos. Por ejemplo, si el paciente recibe dosis muy altas de agentes sedantes durante mucho tiempo, podría sufrir atrofia muscular respiratoria y muscular periférica porque no se ha movido durante varios días». También hay otros factores importantes que no están relacionados con la gestión de los ajustes del ventilador y la sedación, como la comprensión y el tratamiento de los motivos de los esfuerzos respiratorios excesivamente altos o bajos. Por ejemplo, los pacientes a menudo se sienten incómodos o ansiosos y estos factores deben abordarse.
Técnicas de monitorización que ayudan a facilitar la transición
¿Cómo monitorizamos la fuerza del esfuerzo respiratorio del paciente y, por lo tanto, nos centramos en un intervalo intermedio de esfuerzo que facilite la transición de la ventilación totalmente controlada a la ventilación asistida? Existen varias técnicas de monitorización que pueden ayudar en la transición.
La presión esofágica (Pes), por ejemplo, es el estándar de referencia para medir el esfuerzo inspiratorio de un paciente y el riesgo de daños. Esta técnica de medición implica pasar un catéter Pes con una punta de globo al esófago medio para registrar las presiones locales como sustituto de la presión intratorácica. Cuando respiramos, aspiramos aire en el interior de los pulmones y reducimos la presión intratorácica. La Pes mide el cambio en la presión intratorácica generada por los músculos respiratorios.
Según Irene, existen otras dos técnicas que son más sencillas y menos invasivas porque ninguna de ellas (la Pocc y la P0.1) requieren la inserción de un catéter.
«Estos valores se miden con el ventilador, por lo que los llamamos técnicas de monitorización no invasiva», explica Irene. «Ambos se basan en el mismo principio: generar lo que llamamos una pausa al final de la espiración. Es como un apnea mientras el paciente inspira. Cuando el paciente inspira contra una vía aérea cerrada, cualquier cambio en la presión en la vía aérea es proporcional al cambio en la presión intratorácica. Es un truco que utilizamos para imitar lo que veríamos si hubiéramos insertado un catéter esofágico. Podemos medir los cambios en la presión intratorácica sin tener que introducir nada en el tórax. Estas técnicas se utilizan para medir la actividad respiratoria del paciente y comprobar si los esfuerzos son demasiado altos o demasiado bajos. Una vez que tenga una evaluación más detallada del impulso y el esfuerzo del paciente, es posible que tenga que optar por una técnica un poco más invasiva, como la Pes, pero estas dos técnicas, la Pocc y la P0.1, son técnicas de evaluación que se pueden emplear en todos los pacientes con ventilación, porque no es necesario insertar nada».
Otra técnica disponible para monitorizar la actividad y el esfuerzo respiratorios del paciente es la actividad eléctrica del diafragma (Edi). Al igual que la Pes, requiere la inserción de un catéter nasogástrico u orogástrico. No obstante, los catéteres Edi siempre contienen también una sonda de alimentación, que es necesaria en casi todas las situaciones. Se conecta un catéter Edi y el ventilador procesa la señal. La señal Edi se muestra directamente en la pantalla del ventilador y facilita información sobre la magnitud y la sincronización del impulso y el esfuerzo respiratorio del paciente. Por lo tanto, permite a los médicos modificar los ajustes del ventilador y los fármacos para garantizar que el paciente realice un esfuerzo seguro y que haya una mejor sincronía entre el paciente y el ventilador
Lo bueno de este modo es que, dado que es proporcional al impulso y al esfuerzo del paciente, es muy improbable que el ventilador proporcione demasiado soporte; lo que llamamos asistencia excesiva.
Regímenes de ventilación que pueden ser beneficiosos durante la transición
La selección del mejor régimen y los mejores ajustes de ventilación para cada paciente es una de las intervenciones más importantes para lograr una estrategia de ventilación que proteja los pulmones y el diafragma. NAVA es una herramienta importante para muchos pacientes. Es un régimen de ventilación proporcional que utiliza la Edi para ofrecer asistencia ventilatoria en proporción al impulso y esfuerzo del paciente.
«Lo bueno de este régimen es que, dado que es proporcional al impulso y al esfuerzo del paciente, es muy improbable que el ventilador proporcione demasiada asistencia; lo que llamamos asistencia excesiva», afirma Irene.
Otros regímenes, como la presión soporte, pueden ayudar al paciente en exceso o en defecto. La presión soporte es el régimen que se utiliza con mayor frecuencia durante la transición de ventilación mecánica totalmente controlada a asistida.
«La presión soporte proporciona una cantidad fija de soporte para cada esfuerzo respiratorio», explica Irene. «Si el ventilador proporciona una cantidad fija de soporte para cada esfuerzo respiratorio, es probable que el esfuerzo respiratorio del paciente disminuya cuando el ventilador proporcione soporte. Si el soporte es demasiado para el paciente, este tomará una pequeña inhalación que inicia la respiración, pero durante toda la respiración, el paciente es pasivo. Cuando el paciente se duerme en esta situación, a veces sufre apnea, lo que significa que no respira durante varios
segundos. Es posible que el paciente se despierte con dificultades para respirar, algo que obviamente interrumpe el sueño. Esto se denomina apnea durante la presión soporte. La interrupción del sueño es un problema importante en la UCI. Como todos se pueden imaginar, dormir bien en la UCI es muy complicado. Creemos que el sueño tiene una función fisiológica muy importante, concretamente para la curación, por lo que preferimos emplear métodos que potencien una mayor calidad y cantidad del sueño».
Según Irene, los regímenes proporcionales, como NAVA y la ventilación asistida proporcional, tienen el potencial de evitar este fenómeno y pueden mejorar la calidad y la cantidad del sueño en la UCI.
«La cantidad de soporte es proporcional a los esfuerzos del paciente», comenta Irene, «así que esto garantiza que el paciente siga realizando algún grado de esfuerzo respiratorio y rara vez alcanza la apnea, lo que reduce el riesgo de interrupción del sueño y la atrofia diafragmática. Las principales ventajas potenciales de este régimen son la mejora de la sincronía del ventilador del paciente, la prevención de la asistencia excesiva y la atrofia muscular respiratoria, así como la reducción de las interrupciones del sueño. La mayoría de los pacientes pueden beneficiarse de NAVA, excepto aquellos que tienen una actividad respiratoria y un esfuerzo excesivos debido a una función cerebral anormal y no responderán a los ajustes de la configuración del ventilador o a la sedación. En estas circunstancias, los regímenes proporcionales, incluida NAVA, a veces ofrecen una asistencia excesiva que puede agravar la lesión pulmonar del paciente».
En conclusión, a pesar de que la transición entre la ventilación mecánica totalmente controlada y la asistida es extremadamente difícil, las técnicas de monitorización disponibles actualmente, junto con la implementación segura de regímenes proporcionales de ventilación, pueden ayudar a lograr una ventilación eficaz y personalizada de protección del pulmón y el diafragma que, en última instancia, avanzará hacia la extubación del paciente.
Técnicas de monitorización
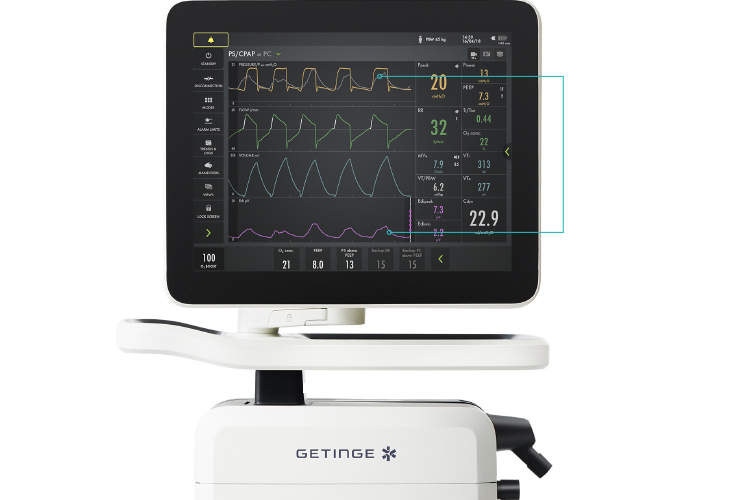
La actividad eléctrica del diafragma (rosa) puede ayudar a los médicos a modificar los ajustes del ventilador y los fármacos para garantizar que el paciente realice un esfuerzo seguro y que haya una mejor sincronización entre el paciente y el ventilador (superposición gris en la curva de presión, amarilla).