Shock cardiogénico
El tiempo lo es todo

Puede ocurrir en cualquier lugar[1]



Los pacientes con shock cardiogénico representan un amplio espectro de enfermedades que requieren un tratamiento a medida para mejorar los trastornos hemodinámicos[2]
Desarrollo de un plan de tratamiento
Identificación
Cualquier intento de mejora de las repercusiones del shock cardiogénico (SC) comienza con su identificación temprana. Los modelos de atención que incluyen un equipo multidisciplinar de SC ofrecen potencial para la identificación temprana y el tratamiento individualizado del SC.[3]
Evaluación
Se requieren bucles de retroalimentación rápida que incorporen el estado y los parámetros hemodinámicos del paciente para evaluar la necesidad de respuesta a las terapias iniciales.[2]
Escalada
Si los pacientes no responden a los tratamientos aplicados, plantéese pasar al siguiente nivel de soporte y transfiéralos a centros con experiencia en shock si es necesario.[4]
La identificación es fundamental
Fases del shock cardiogénico[4]
En riesgo: Paciente con factores de riesgo de shock cardiogénico que actualmente no experimenta signos o síntomas. Por ejemplo, infarto agudo de miocardio, infarto previo, insuficiencia cardíaca aguda y/o crónica en fase aguda.
Inicio: Paciente que presenta evidencia clínica de hipotensión relativa o taquicardia sin hipoperfusión.
Clásico: Paciente que presenta hipoperfusión y requiere intervención más allá de la reanimación con volumen (inótropico, vasopresores o soporte mecánico). Por lo general, estos pacientes suelen presentar hipotensión relativa.
Deterioro: Paciente que no responde a las intervenciones iniciales. Es similar a la fase C, pero sigue empeorando.
Extremis: Paciente que está siendo apoyado por múltiples intervenciones y que puede estar experimentando un paro cardiaco con reanimación cardiopulmonar (RCP) en curso.
Cualquier intento de mejora de las repercusiones del shock cardiogénico comienza con una identificación temprana. Los modelos de atención que incluyen un equipo multidisciplinar de SC ofrecen potencial para la identificación temprana y el tratamiento individualizado.[3]
Inicio temprano
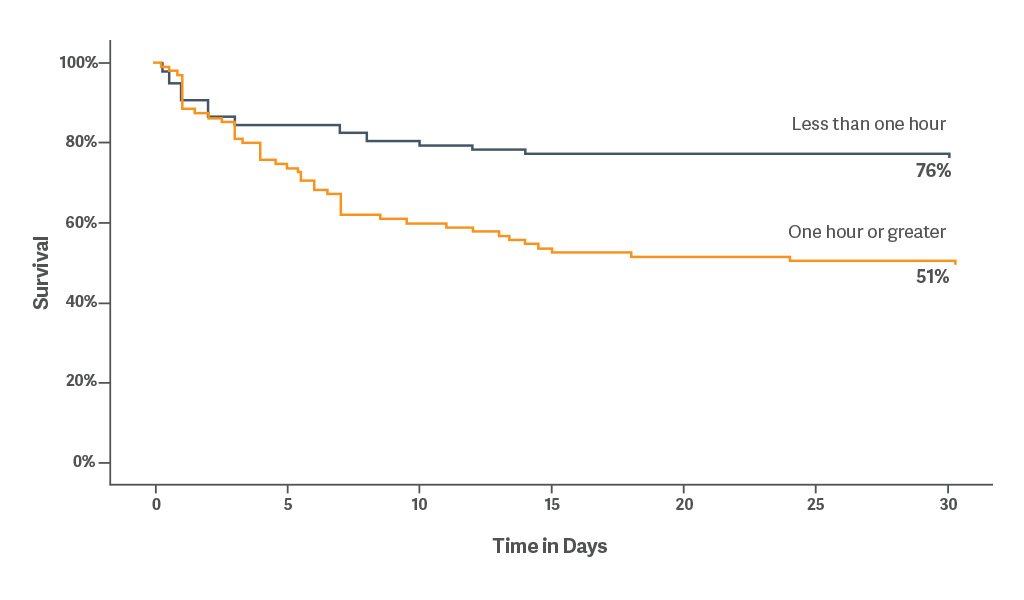
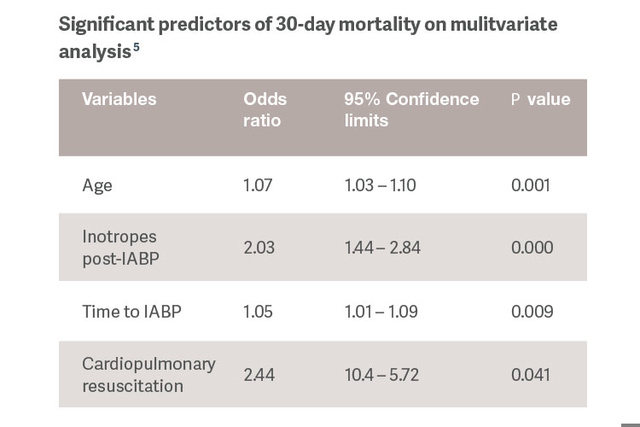
El análisis retrospectivo indica que la aplicación de un soporte circulatorio mecánico (MCS, por sus siglas en inglés) en un estadio inicial es una intervención terapéutica importante. El uso temprano de la contrapulsación por balón intraaórtico está asociado a los beneficios de la supervivencia, independientemente de la etiología.[5]
La supervivencia a los 30 días fue del 76 % al aplicar la IABP en menos de una hora desde el inicio del shock cardiogénico.[5]
El inicio temprano de la IABP puede ofrecer beneficios hemodinámicos como tratamiento principal para la insuficiencia cardíaca descompensada avanzada.[6]
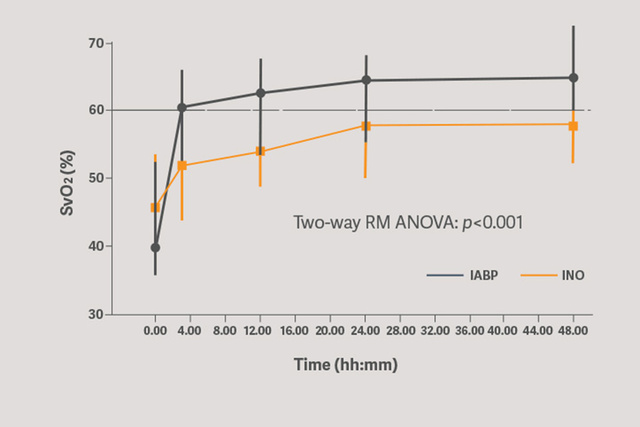
El soporte circulatorio primario con la IABP Sensation Plus de 50 cc mostró un aumento significativo en la perfusión orgánica mejorada evaluada por SVO2.[6]
Iniciar inmediatamente el soporte reduce los efectos de un accidente cerebrovascular, y posiblemente el consumo de oxígeno miocárdico. La contrapulsación de la IABP disminuye la poscarga de baja tensión, la precarga y la disincronía intraventricular.[6]
Evaluación de su eficacia
Permite adaptar y escalar la atención al paciente según sea necesario. La evaluación de la respuesta al tratamiento es fundamental para poder realizar ajustes en el plan de cuidados.[2]
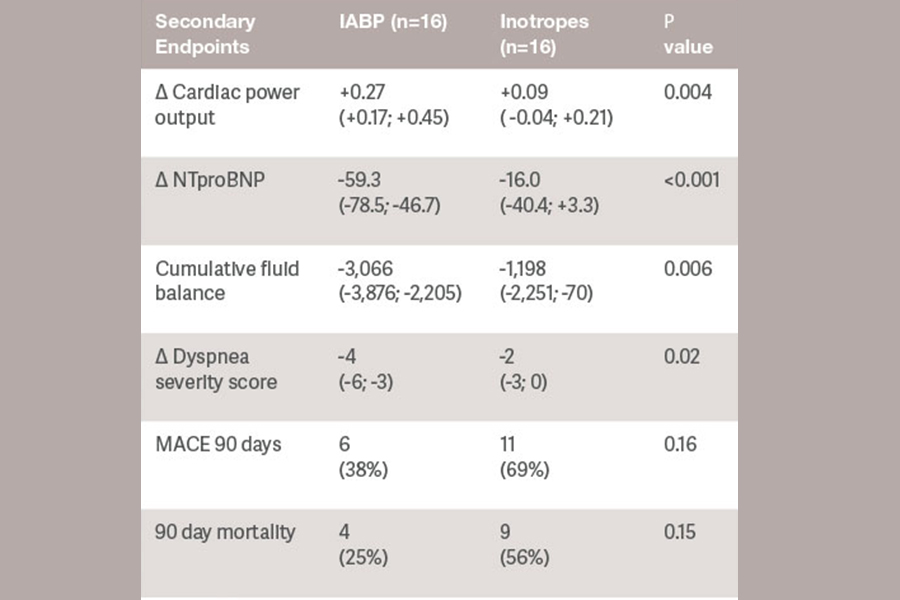
La identificación de los indicadores de respuesta al soporte con IABP nos permitiría personalizar el tratamiento y reservar el uso de dispositivos de SCM más potentes para los pacientes en fases más avanzadas de SC.[5]
IABP: la opción segura de SCM de primera línea
| Artículo | Número de pacientes | Mortalidad | Hemorragia | Accidente cerebrovascular | Complicaciones vasculares |
Insuficiencia renal aguda |
| Dhruva 2019[8] | 1680 Pares coincidentes de NCDR* |
Favorece la IAB Diferencia absoluta de la IAB del 10,9 % |
Favorece la IAB Diferencia absoluta de la IAB del 15,4 % |
No aplicable | No aplicable | No aplicable |
| Amin 2019[9] | 48 306 Base de datos de Premier* |
Favorece la IAB p < 0,0001 |
Favorece la IAB p < 0,045 |
Favorece la IAB p < 0,0001 |
No aplicable | Favorece la IAB p = 0,052 |
| Wernly 2019[10] | 588 Metaanálisis de cuatro RCT** |
Sin diferencias p = 0,38 |
Favorece la IAB p = 0,002 |
Sin diferencias p = 1,00 |
Favorece la IAB p = 0,01 |
No aplicable |
| Schrage 2011[11] | 237 Pares coincidentes del IABP-Shock II** |
Sin diferencias p = 0,64 |
Favorece la IAB p < 0,01 |
No aplicable | Favorece la IAB p = 0,01 |
No aplicable |
*Impella vs. IABP
**Impella vs. control (IABP y/o tratamiento médico)
Las complicaciones son importantes
Sin aumento de sangrado gracias a la IABP
| Ensayo | IABP | Sin IABP |
Valor P |
| CRISP AMI: hemorragia grave[12] | 3,1 % | 1,7 % | 0,49 |
| CRISP AMI: episodio vascular grave[12] | 4,3 % | 1,1 % | 0,09 |
| SHOCK II: hemorragia moderada[13] | 17,3 % | 16..4% | 0,77 |
| SHOCK II: hemorragia grave[13] | 3,3 % | 4,4 % | 0,51 |
| SHOCK II: episodio vascular grave[13] | 4,3 % | 3,4 % | 0,53 |
Inscripción en el ensayo: CRISP AMI, n = 337; SHOCK II, n = 600