Cómo puede ayudarle la monitorización del diafragma a mejorar la ventilación mecánica
El soporte respiratorio es una intervención que salva vidas en la UCI, pero, sin el equilibrio adecuado, también aumenta el riesgo de resultados perjudiciales.[1],[2] Esto sucede cuando la monitorización del diafragma puede ayudar, porque es un marcador de resultados como la mortalidad hospitalaria y el destete prolongado. Además, puede ayudarle a tomar decisiones terapéuticas más fundamentadas durante todo el tratamiento respiratorio.
El impacto clínico de las lesiones del diafragma
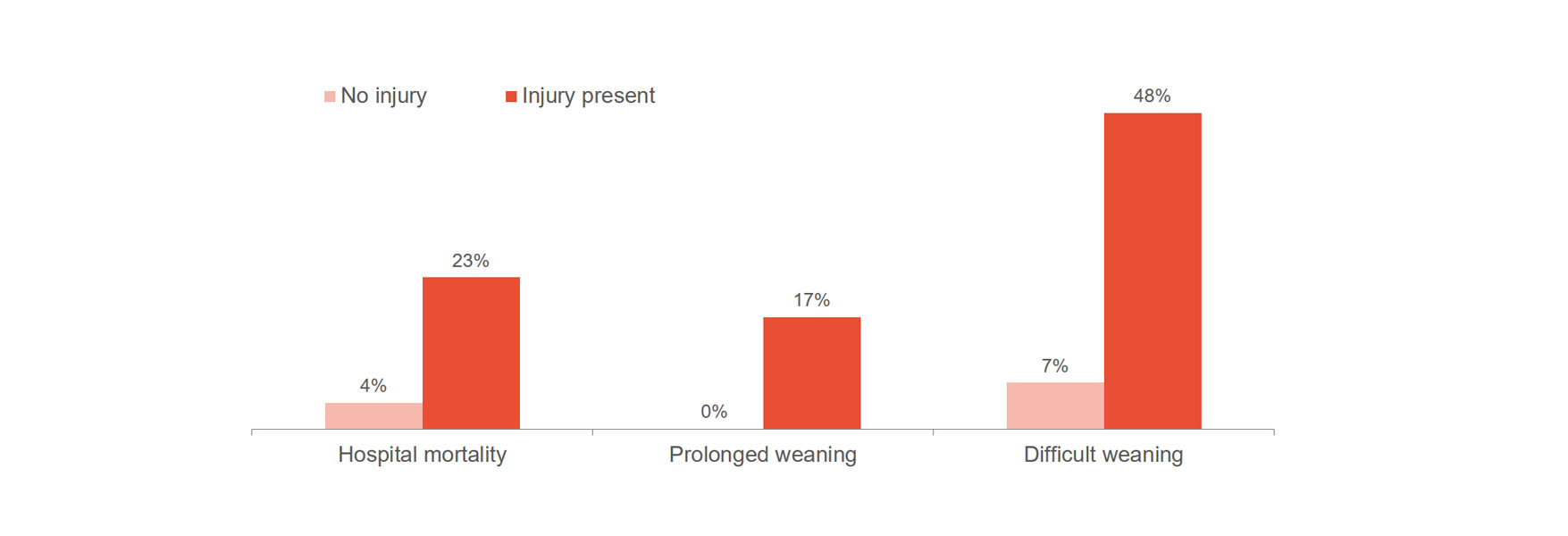
La lesión en el diafragma aumenta significativamente el riesgo de empeoramiento de los resultados, como un destete difícil, un destete prolongado y la mortalidad hospitalaria.[1],[2] Importante: el 23-84 % de los pacientes muestran lesiones significativas en el diafragma en el primer ensayo de respiración espontánea.[3] Un estudio mostró un tiempo medio de ventilación de 576 horas para pacientes con lesiones en el diafragma, en comparación con 203 horas para los pacientes sin lesiones.[4]
Se cree que las causas principales están impulsadas por dos factores.[1] En algunos casos, los pacientes están trabajando demasiado duro para respirar, lo que provoca un engrosamiento del diafragma. En otros casos, los pacientes trabajan muy poco después de una sobre-asistencia y/o ventilación controlada en las primeras etapas de su tratamiento, lo que provoca atrofia. Tanto los cambios en los resultados empeorados como el reto al que se enfrentan los médicos hoy en día es que los diagnósticos de ventilador de uso común no capturan esta información.
¿Por qué el diagnóstico actual del ventilador no es suficiente?
Las curvas del ventilador se utilizan para interpretar las necesidades respiratorias del paciente, pero su función principal es mostrar lo que se suministra al paciente. Esto dificulta la detección de asincronía, exceso de sedación, asistencia excesiva y falta de asistencia durante la respiración espontánea.
Por ejemplo, solo el 21 % de los médicos detecta asincronía en forma de esfuerzos inspiratorios perdidos.[5] Además, puede parecer que un paciente con ventilación con presión soporte está desencadenando respiraciones espontáneas, cuando en realidad no está desencadenando ninguna respiración espontánea.[5],[6]
El resultado es la incertidumbre sobre cuánto esfuerzo respiratorio está realizando su paciente y hasta qué punto está en riesgo de sufrir lesiones de diafragma.
Cómo monitorizar el diafragma
Para tratar de proteger el diafragma, necesita diagnosticar las posibles lesiones y controlar su actividad continua.
Un ultrasonido le ayuda a evaluar la disfunción del diafragma midiendo su grosor y los posibles cambios en el grosor con el paso del tiempo. Los recientes avances en generación de imágenes por ecografía permiten a los médicos evaluar con mayor viabilidad el funcionamiento del diafragma y, potencialmente, protegerlo durante la ventilación mecánica.[7]
Para una respiración continua, la monitorización de la función del diafragma es la actividad eléctrica del diafragma (Edi). Es una herramienta de diagnóstico a pie de cama obtenida mediante una sonda de alimentación especialmente diseñada. La señal de tensión se muestra con forma de onda junto a las ondas de presión / flujo convencionales del paciente y muestra la presencia, ausencia y tipo de respiración.
Edi puede ayudarle a entender el trabajo respiratorio, detectar asincronías y evaluar hasta qué punto la asistencia excesiva o insuficiente y la sedación afectan a la capacidad respiratoria.[8],[9] También puede detectar cambios en el esfuerzo tras las intervenciones. Por ejemplo, cuando cambie la posición del paciente o, todavía más importante, cuando reduzca el soporte ventilatorio durante el destete, administre medicamentos como Salbutamol.
Podría decirse que para obtener una imagen completa es necesario combinar la ecografía y la monitorización continua del diafragma (Edi).
Cómo la monitorización del diafragma puede ayudar a proteger al paciente y simplificar el destete
Para evitar lesiones pulmonares inducidas por el ventilador, debe intentar evitar la ventilación invasiva, las asincronías y la asistencia excesiva o insuficiente, así como periodos prolongados de sedación e inactividad del diafragma. Los pacientes que «luchan contra el ventilador» a menudo pierden. El resultado es un aumento de la sedación, una ventilación prolongada y posiblemente una intubación.
La monitorización del diafragma puede ayudar a gestionar estos desafíos.[10],[11],[12] Le ayuda a ver los esfuerzos realizados por el paciente, respiración a respiración. Y puede ver si el ventilador responde a tiempo, con la cantidad adecuada de soporte, porque tiene un valor fisiológico objetivo para guiarle.
En la terapia no invasiva, esto puede ayudarle a adaptar el tiempo y el soporte del ventilador, lo que puede reducir la necesidad de intubar. Una buena interacción paciente-ventilador es uno de los factores clave del éxito de la VNI.[13]
La monitorización continua también puede servir como indicador en tiempo real del esfuerzo respiratorio, lo que le ayuda a entender cuándo es realmente necesaria la intubación. Incluso puede ayudarle a optimizar el tiempo de los ensayos de respiración espontánea, así como a hacer que sigan adelante con más éxito, con más frecuencia.
Cómo puede ayudar la monitorización del diafragma a reducir el tiempo de funcionamiento del ventilador
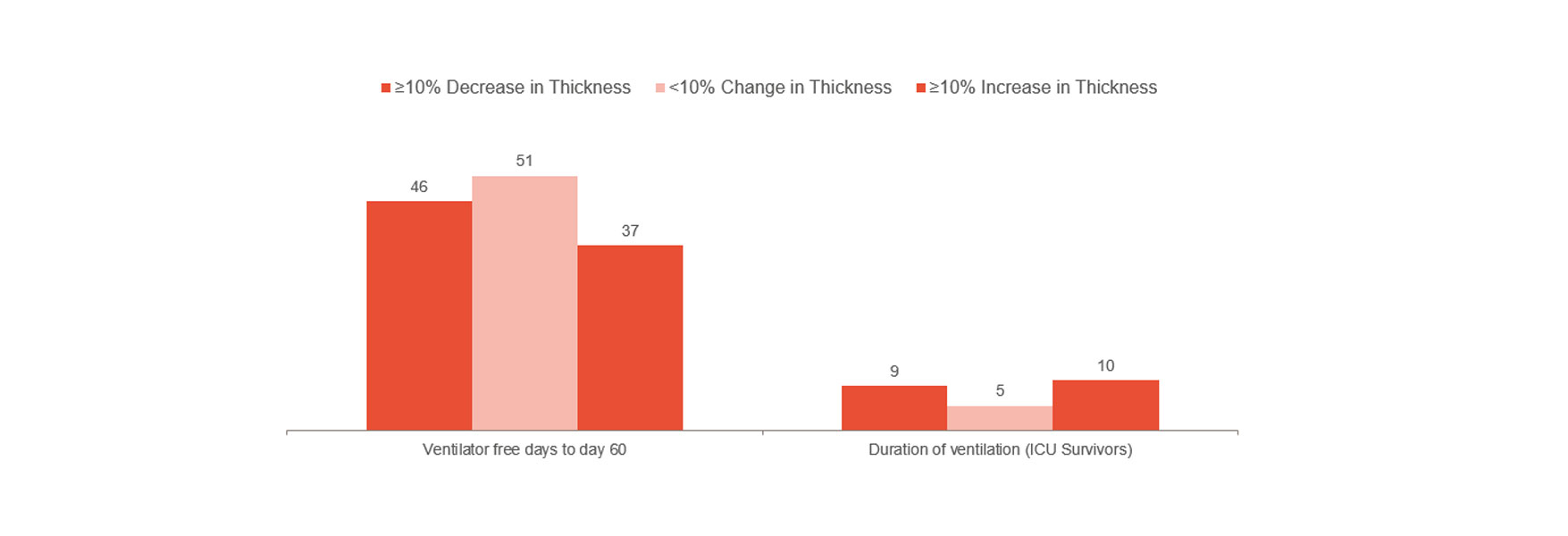
Golfigher demostró que el cambio temprano del grosor del diafragma era un marcador de la duración de la estancia en la UCI y otras complicaciones como la reintubación, la traqueostomía, la ventilación mecánica prolongada y la muerte.[1] Indica que permanecer dentro de una fracción de engrosamiento del 10-20 % puede ser la mejor forma de avanzar. Como tal, puede proporcionarle indicaciones sobre el riesgo del paciente y ayudarle a optimizar el tratamiento. Para comprender mejor si evitar lesiones en el diafragma podría evitar complicaciones, se requieren ensayos clínicos aleatorios.
Sin embargo, de acuerdo con lo anterior, es la experiencia clínica de un hospital londinense lo que indicó una reducción significativa del tiempo dedicado a la ventilación mecánica durante la monitorización de la actividad del diafragma.[14] El grupo no monitorizado tuvo una mediana de 12 días de ventilación mecánica en comparación con los 9 días del grupo monitorizado (103 pacientes de 493).
La monitorización del diafragma también puede ayudarle a descubrir alteraciones, como el síndrome de hipoventilación central congénita y el daño nervioso frénico.[15],[16]
Cómo la monitorización del diafragma puede ayudarle a tomar decisiones más fundamentadas sobre el tratamiento
La monitorización de la actividad del diafragma puede ayudarle a tomar decisiones más fundamentadas para su paciente durante todo el tratamiento y proporcionar información valiosa en varios momentos decisivos.
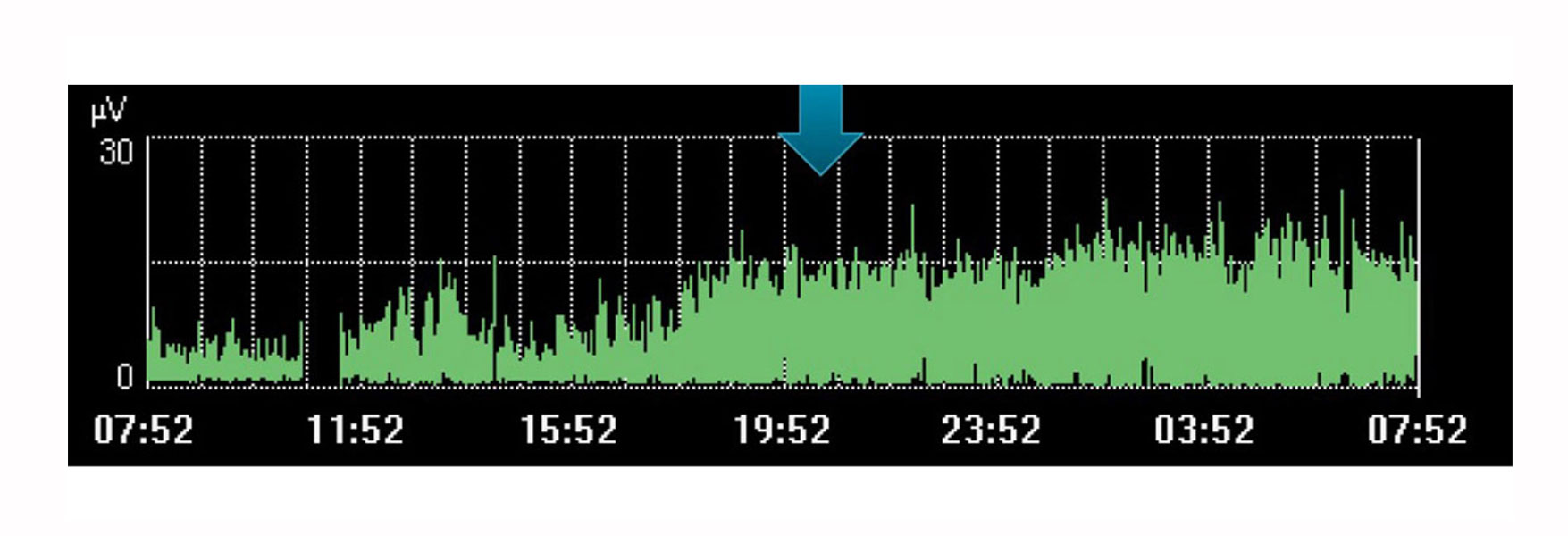
Monitorización y tendencia del trabajo respiratorio
Los informes recientes indican que la monitorización del diafragma con Edi es útil para monitorizar el esfuerzo respiratorio y la interacción paciente-ventilador.[18]
Por supuesto, la monitorización de Edi tiene limitaciones como valor único y aislado. Al igual que otras variables fisiológicas, debe tenerse en cuenta junto con otras mediciones, así como en el contexto de los cambios en el tratamiento, una tendencia que puede ayudarle a determinar si el paciente se mueve en la dirección deseada.
Por ejemplo, la imagen anterior muestra un aumento del esfuerzo del diafragma durante un tiempo en el que el médico había planificado un descanso para el paciente. La tendencia indica que no ocurrió, se ve por el aumento del esfuerzo realizado por el paciente durante este tiempo.
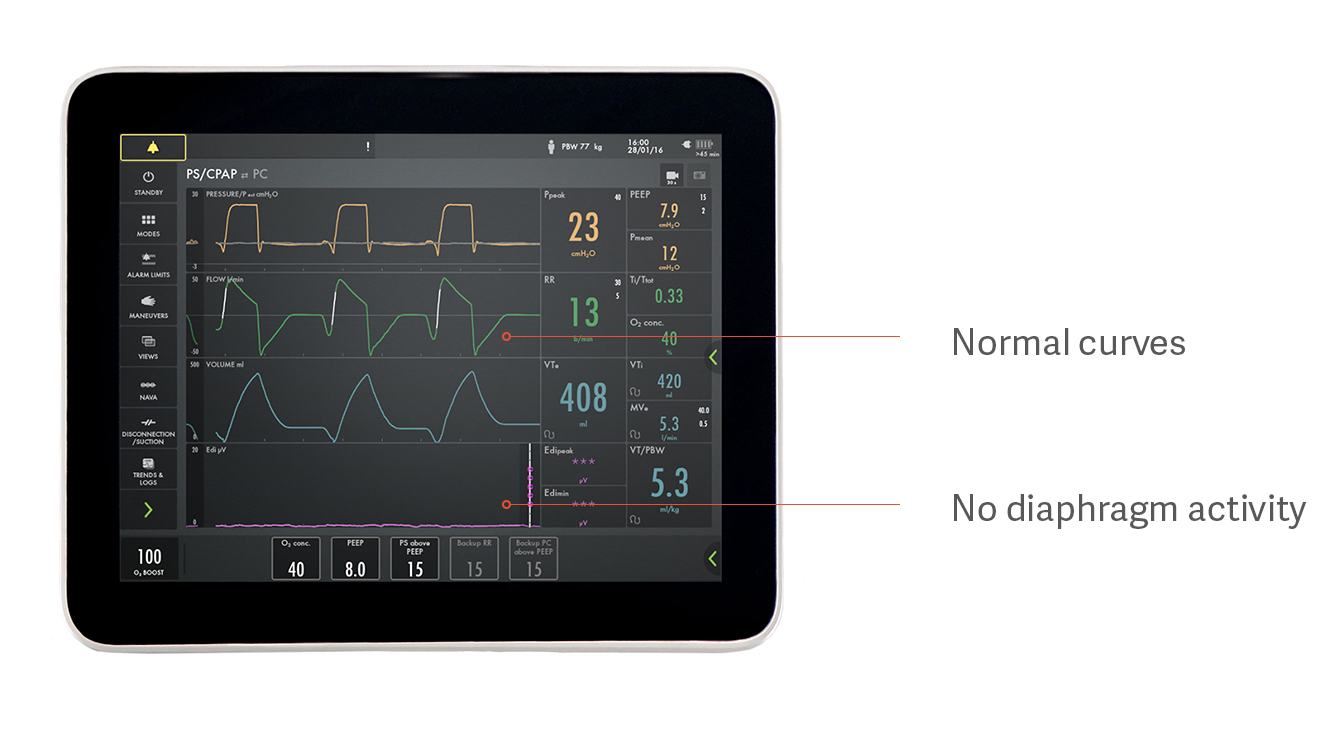
Identificación de asistencia excesiva e insuficiente
Para evitar que el paciente sufra lesiones en el diafragma, el diafragma debe estar activo a un nivel adecuado. Esto es difícil de ver sin monitorizar el diafragma.
Por ejemplo, puede parecer que un paciente respira espontáneamente con presión soporte pero, de hecho, no está utilizando su diafragma en absoluto, como se indica en la imagen anterior. Este es un ejemplo de cómo la asistencia excesiva evita que el diafragma funcione, lo que da lugar a atrofia del diafragma. Las curvas de presión, flujo y volumen parecen normales, pero la señal Edi morada de la parte inferior es plana, lo que indica que el diafragma está inactivo.
Otro ejemplo es la falta de asistencia, que es lo contrario de la asistencia excesiva e igual de malo para el paciente. Un paciente con asistencia insuficiente hace demasiado esfuerzo para respirar, lo que provoca el engrosamiento del diafragma. Quizás sea más fácil de observar en el paciente, pero sin un valor objetivo en el ventilador es difícil saberlo con certeza.
Ambos ejemplos de lesiones del diafragma (atrofia y engrosamiento) se observan con frecuencia en pacientes y se asocian con peores resultados clínicos.[1]
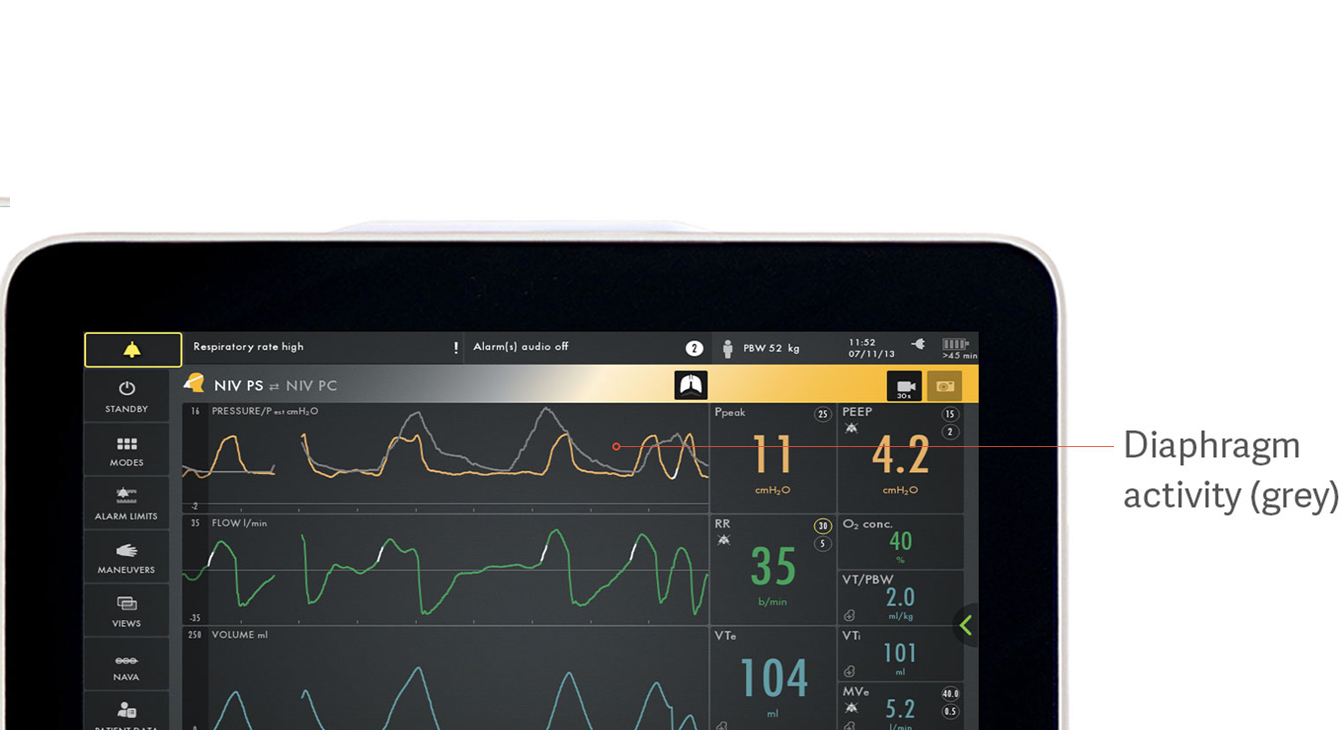
Identificar una asincronía paciente-ventilador
La asincronía se asocia a resultados clínicos más pobres durante la ventilación mecánica.[18] En un estudio reciente, solo el 21 % de los médicos consiguió detectar la asincronía en forma de esfuerzos inspiratorios perdidos.[5] Hay muchos más tipos de asincronías que se pueden pasar por alto fácilmente: esfuerzos ineficaces o excesivos, esfuerzo inspiratorio retardado, retraso en el apagado de los ciclos, doble disparo y autodisparo.
La imagen muestra cómo la actividad eléctrica del diafragma en gris se superpone a la curva de presión (amarilla), lo cual facilita la observación de las diferencias entre lo que el paciente solicita y lo que suministra el ventilador.
Determinar el régimen de ventilación
Su objetivo debe ser que el paciente mantenga un esfuerzo respiratorio óptimo que no represente demasiado poco esfuerzo ni demasiado esfuerzo.[1] Mediante la monitorización continua de la actividad del diafragma, usted tendrá una indicación de cuánto está trabajando el paciente, si es que lo está haciendo. Si la actividad del diafragma es alta y aumenta, es posible que tenga que aumentar el nivel de soporte.[19],[20],[21]
Si la actividad es baja o se reduce, es posible que pueda reducir el nivel de soporte.[19] Es importante supervisar también otros parámetros de diagnóstico asociados a la ventilación antes de cambiar el soporte. La investigación está creciendo en esta área. En el futuro, un mayor conocimiento de los parámetros del diafragma puede mejorar aún más la evaluación.[22]
Ajuste de una PEEP óptima
No existe una forma estandarizada de ajustar la PEEP del paciente durante la respiración espontánea. Sin embargo, una PEEP bien ajustada puede reducir la atelectasia, abrir y cerrar cíclicamente las vías respiratorias y proteger los alvéolos. Esto, a su vez, optimiza la mecánica pulmonar y mejora la oxigenación.
El ajuste de PEEP con monitorización del diafragma ha mostrado resultados claros en neonatos, lo que permite al bebé relajarse adecuadamente entre las respiraciones y evitar el desreclutamiento pulmonar.[12]
En pacientes adultos, Passath utilizó la monitorización del diafragma y el oxígeno durante los cambios de PEEP para permitir la identificación de un nivel de PEEP en el que la respiración corriente se produce con un esfuerzo mínimo.[23] La disminución excesiva de PEEP dio lugar a un aumento del trabajo respiratorio del 50 al 60 %, lo que, en combinación con el empeoramiento del oxígeno, también sugirió una reducción parcial del volumen de aire.
Optimización de la gestión de la sedación
La principal ventaja de supervisar la actividad del diafragma en relación con la sedación es tratar de mantener el diafragma activo en la medida de lo posible.[1] Solo hay que controlar la actividad del diafragma del paciente y la respuesta a la ventilación para encontrar un nivel de sedación adecuado con una actividad continuada del diafragma.
Puede ser necesario cierto entrenamiento para diferenciar el efecto de la sedación de otras fisiologías que pueden afectar al funcionamiento del diafragma; sin embargo, Edi es especialmente eficaz durante las pausas de sedación, ya que puede ver continuamente el esfuerzo cambiante realizado por el paciente.
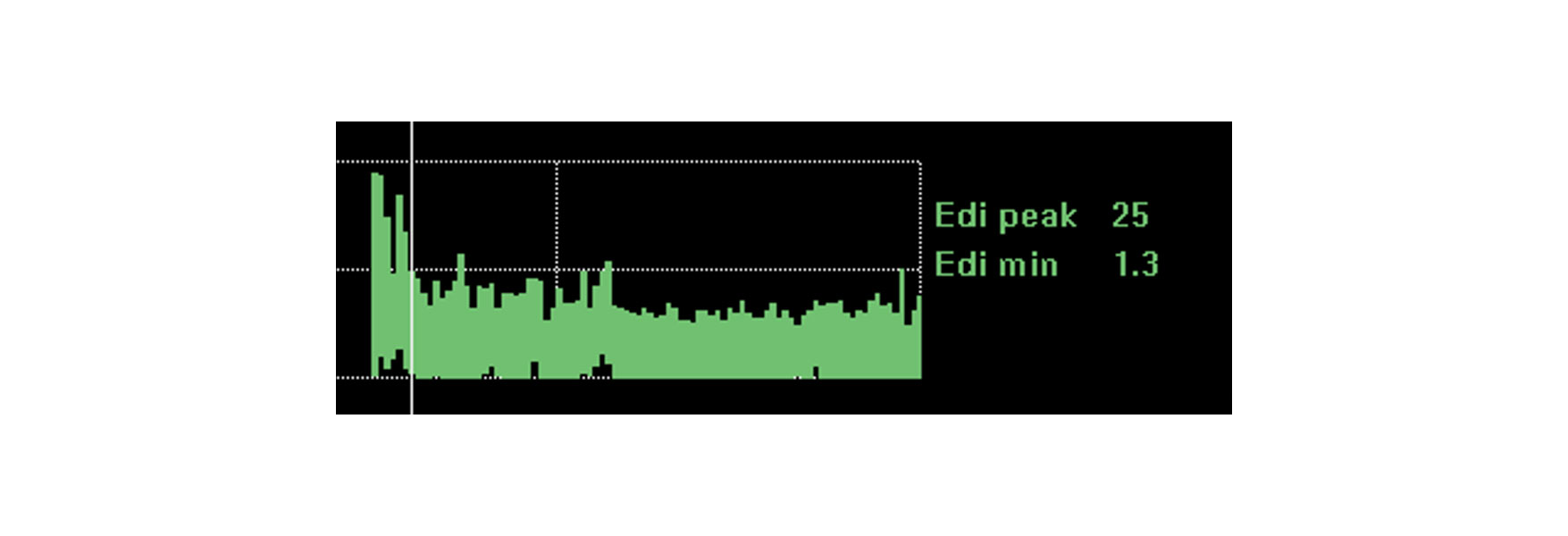
Tendencia y monitorización del impacto de las intervenciones, el descanso y la rehabilitación
La monitorización de la actividad del diafragma proporciona una mayor tranquilidad para que el paciente pueda hacer frente a los cambios que usted hace. La actividad del diafragma se ve afectada por una serie de cambios fisiológicos, como el descanso, la posición sentada, caminar, el tratamiento con cafeína e incluso la rehabilitación y recuperación globales.
Si el paciente se enfrenta a estos cambios, la actividad del diafragma puede permanecer prácticamente sin cambios. Lo más probable es que un empeoramiento de la situación clínica y la necesidad de un mayor trabajo respiratorio aumenten la actividad del diafragma. Una posición de reposo mejorada reducirá la actividad del diafragma necesaria para generar respiraciones.
La imagen muestra la actividad continua del diafragma de un paciente que estaba a punto de intubarse debido a problemas respiratorios agudos tras una neumonía. Mediante la monitorización de la actividad del diafragma, el médico logró optimizar el soporte y dar la vuelta a la situación.
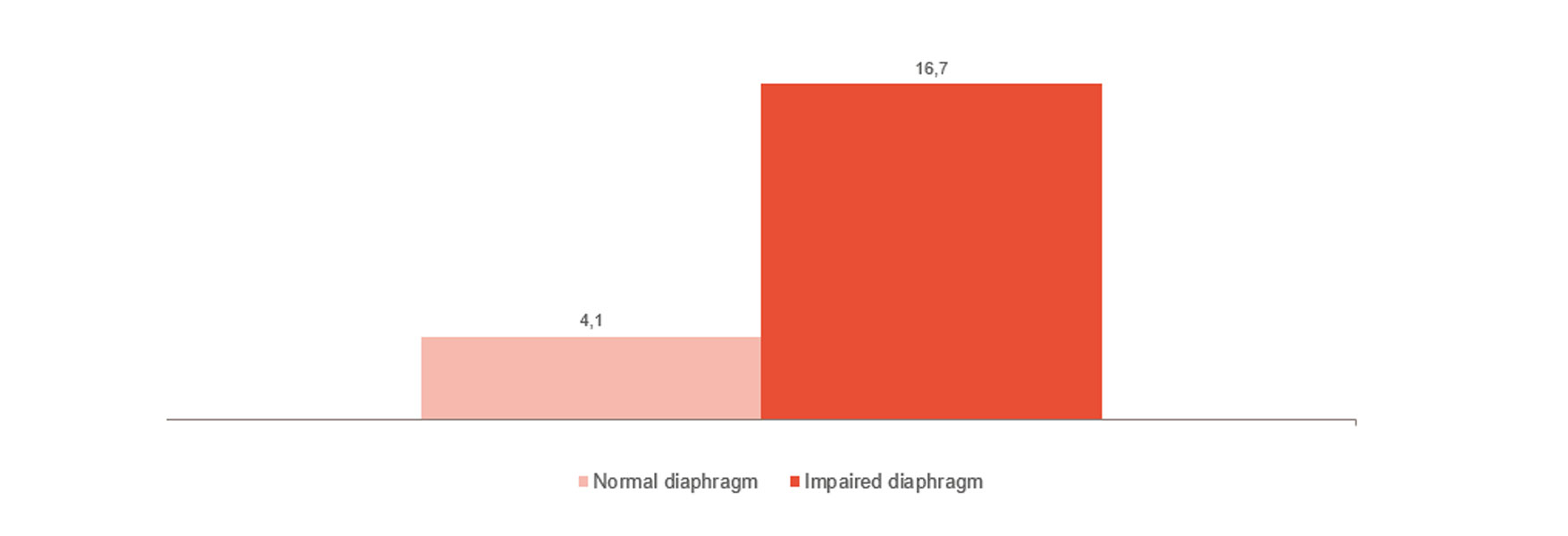
Monitorización y tendencia de destete
Como se muestra en la imagen, la disfunción del diafragma está fuertemente relacionada con las dificultades de destete.[4] Supervisar la actividad del diafragma puede ayudarle a predecir la preparación para el destete y supervisar su progreso.[24],[25],[26] Desde la ventilación invasiva hasta la ventilación no invasiva, la terapia de alto flujo y el momento en el que se ha retirado todo el soporte.
La capacidad de su paciente para hacer frente a la reducción del soporte se indica en cuestión de minutos y puede ayudarle a continuar con el soporte o ajustarlo. Puede que sea necesario volver a los ajustes anteriores para evitar la recaída del paciente y las complicaciones que a menudo se derivan de ella.
