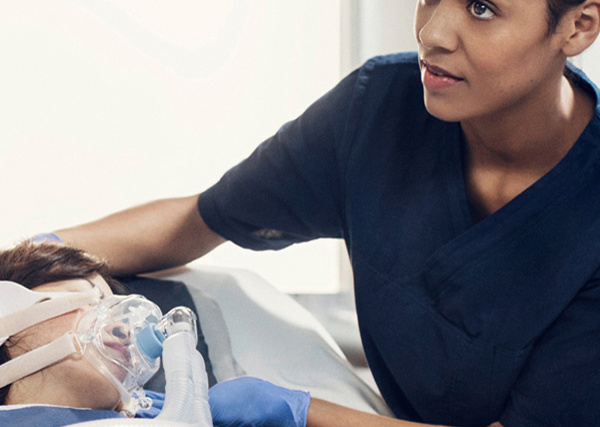
Wir schaffen die Pflegeumgebung von morgen
Der Intensivpflege steht eine bessere Zukunft bevor. Mehr skalierbare Infrastruktur. Effizientere Arbeitsabläufe. Und eine bessere Umgebung für Patientinnen, Patienten und Personal. Getinge leistet einen Beitrag, indem wir Infrastruktur, Therapien und Dienstleistungen schaffen, die darauf abzielen, die Intensivpflege reaktionsschneller und widerstandsfähiger zu machen als je zuvor. Ob schlüsselfertige Pflegeeinrichtungen, flexible mobile Intensivstationen oder fortschrittliche personalisierte Therapien – wir helfen Krankenhäusern weltweit, Lösungen für einige der wohl zeitlosesten Herausforderungen in der Intensivpflege zu entwickeln.
Setzen Sie mit uns heute die Maßstäbe für morgen.
Unsere Lösungen für Ihre Anforderungen
Akutes Atemnotsyndrom (ARDS)
ARDS ist ein Syndrom, das offenbar selten erkannt, unterbehandelt und mit einer hohen Sterblichkeitsrate verbunden ist.
Leise ITS
Intensivstationen können sowohl auf Patientinnen und Patienten sowie Angehörige als auch auf das medizinische Personal stressig und bedrohlich wirken.
Kardiogener Schock
Jeder Versuch, die Ergebnisse der Behandlung zu verbessern, sollte mit der Früherkennung eines kardiogenen Schocks beginnen.

ITS-Lösungen einfach entdecken: Getinge Virtual Hospital
Haben Sie sich schon immer gefragt, wie Technologien in einer Krankenhausumgebung funktionieren und zusammenwirken? Mit dem innovativen Getinge Virtual Hospital können Sie sich unabhängig durch das Krankenhaus bewegen und das genauer ansehen, was für Sie am wichtigsten ist. Sie können Elemente bewegen, für eine Rundumansicht drehen oder für detaillierte Produktinformationen anklicken. Es kommt einer tatsächlichen Krankenhausumgebung unglaublich nahe.
Getinge hält eine umfassende Palette an Produkten und Dienstleistungen zur Unterstützung Ihres Krankenhauspersonals und der Verbesserung der Patientenversorgung bereit. Unabhängig davon, ob Sie an Geräten, Software oder einer grundlegenden Überarbeitung Ihrer Einrichtung interessiert sind – Getinge Virtual Hospital zeigt Ihnen die Produktdetails in einem breiteren Kontext.
Nutzen Sie dieses Tool, um zu erfahren, wie sich mit Getinge Ihre Patientenversorgung verbessern und Ihre Arbeitsabläufe optimieren lassen.
Denken Sie horizontal!
Getinge hat ein horizontales Versorgungssystem für spezielle klinische Anforderungen entwickelt: Maquet Moduevo Bridge.
Dieses wirtschaftliche und platzsparende Medienbrückensystem soll zu einer verbesserten Interaktion des behandelnden Personals mit Patientinnen und Patienten aller Akuitätsgrade beitragen. Die Haupteinsatzbereiche von Maquet Moduevo Bridge sind die Intensivstation, die Neugeborenenintensivstation, die Intensivüberwachungsstation (IMC), sowie Aufwachräume und Aufwachbereiche.
Lernen Sie unsere Produkte kennen
Finden Sie die richtigen Produkte und Lösungen