課題:
ARDS 患者に対する
体液量管理の最適化
重篤な患者の予後は、治療の経過とともに適切な治療の選択ができているかどうかで決定されます。ARDSでは、肺血管透過性が高まり、肺水腫が発生するため、この点がさらに重要になります。適切な治療を行うためには、患者の循環動態の状態を早期に把握することが必要です。治療方針を迅速に決定することが、患者の転帰に影響を及ぼします。
肺水腫の定量化は可能か?
過去20年間、経肺熱希釈法(TPTD)が様々な重症患者に使用されてきました。[1] TPTD法では,肺血管外水分量係数(ELWI)と肺血管透過性係数(PVPI)により、肺水腫の定量化が可能です。PVPIは、肺水腫の原因が心原性か非心原性によるものかの鑑別診断を可能にします。ELWIおよびPVPIは、輸液管理の指標として使用することができます。[2]
肺血管外水分量とは、肺胞および/または肺胞の間質に蓄積された水分の総称です。肺血管透過性係数(PVPI)は、肺胞―毛細血管の透過性を間接的に反映しています。
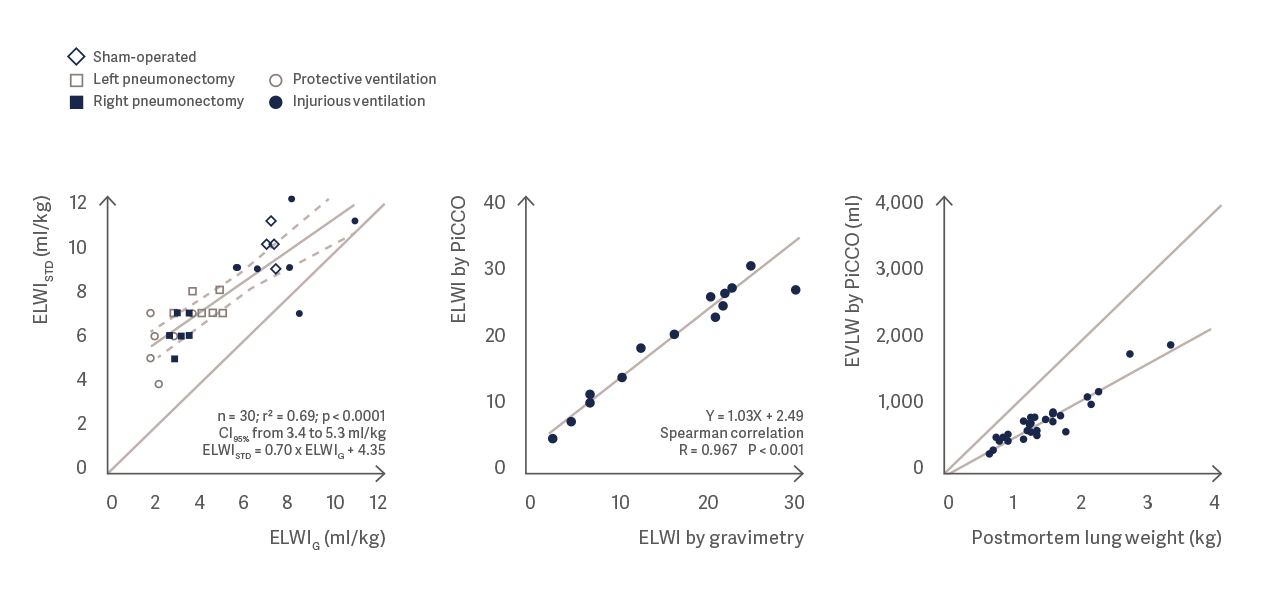
PiCCOを用いた肺血管外水分量の測定は、重量法による測定や剖検の肺重量と非常によく相関しています。 [3], [4], [5]
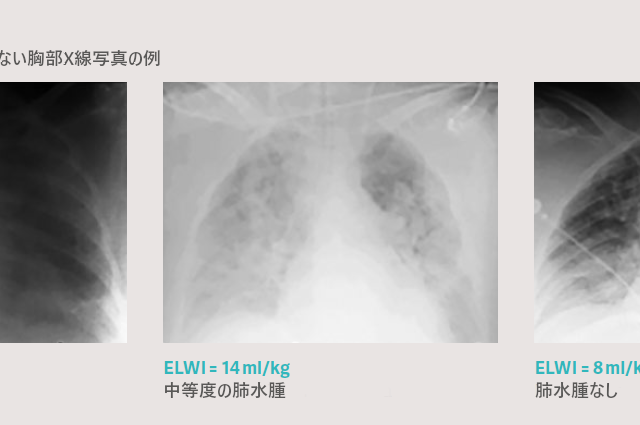
心原性肺水腫か非心原性肺水腫か?
PVPIは、肺胞-毛細血管の透過性を間接的に反映するものです。ELWIと肺血液量(PBV)の関係から算出され、血管内に留まる水分量に対する血管外に出る水分量の比率になります。[9]
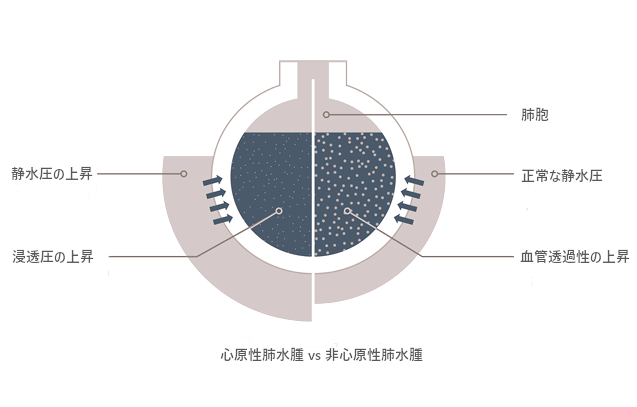
心原性肺水腫
血管内容量が過剰になると静水圧が上昇します。
そのため、血管外に水分が漏れてしまいます。
透過性亢進型肺水腫
血管透過性は、敗血症などによる炎症反応によって上昇します。これにより、血管内容量や静水圧が正常もしくは低い場合でも、血管内から血管外への水分、電解質、タンパク質の移動が増加します。
ELWIとPVPIの相互作用は臨床的に有益である
ARDSのような複雑な症候群では、肺水腫を特定して定量化することが転帰に影響します。肺水腫が蓄積すると、呼吸器系のガス交換が損なわれ、呼吸困難に陥ります。ELWIとPVPIのパラメータは、ベッドサイドで肺水腫を鋭敏に定量化することができます。また、ARDSの重症度を評価することも可能です[2]。
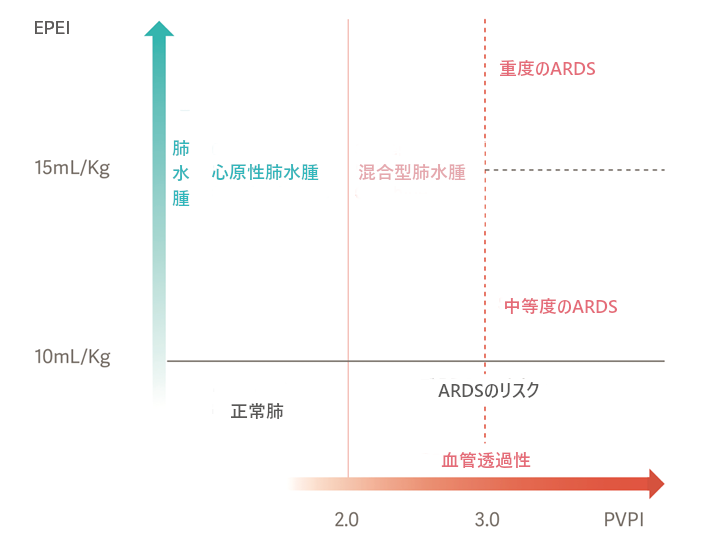
ARDS患者は、ELWIとPVPIを用いることでARDSを引き起こしている原因の診断を行うことが可能です。PVPIが3以上でELWIが10ml/kg以上の場合、肺血管透過性の高い肺水腫、すなわちARDSを意味します。[2]
PiCCOに基づくARDS管理が転帰を改善
ARDSに関しては、肺血管外水分量測定を含むプロトコルに基づいた管理は安全とされ、輸液の過剰投与の回避、ICU死亡率の改善、人工呼吸器装着期間の短縮、ICU滞在期間の短縮や治療費が削減されることが研究で示唆されています。[10]
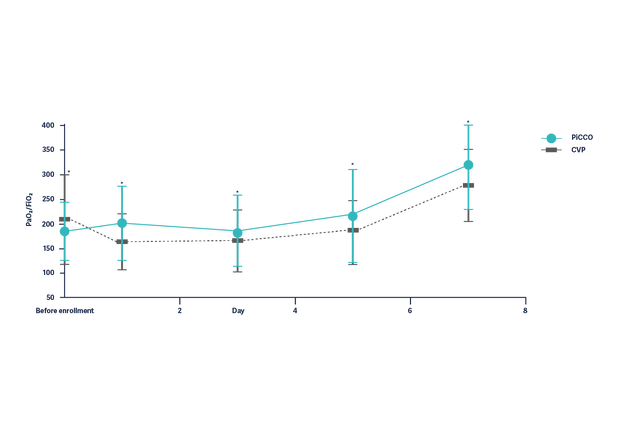
Improvement of the oxygenation (PaO2/FiO2) in ARDS patients over 7 days is significantly better in patients with hemodynamic management based on PiCCO parameters.