横隔膜損傷の臨床的影響
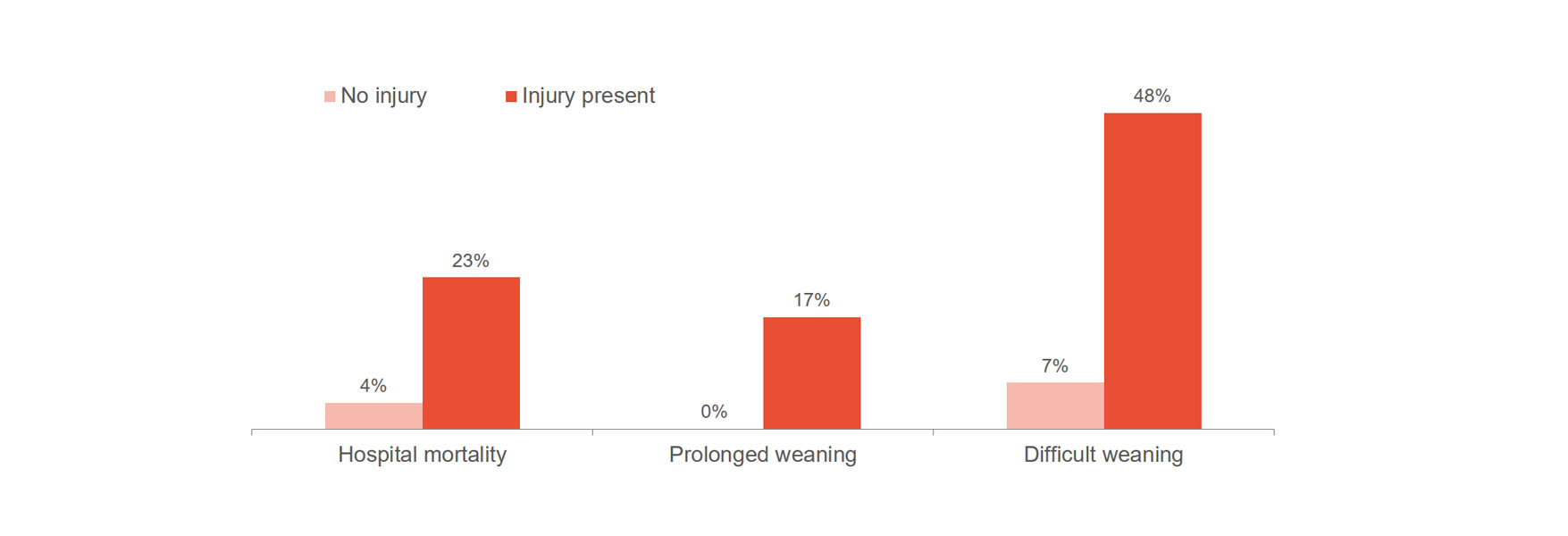
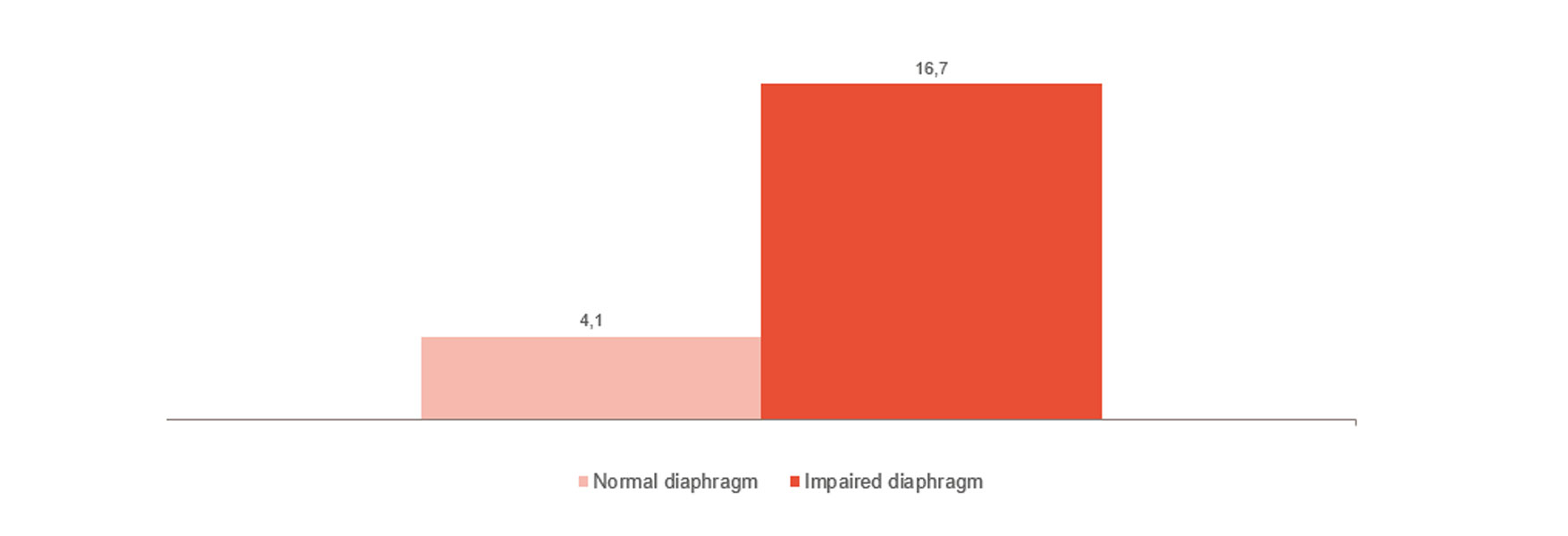
横隔膜の損傷は、困難なウィーニング、ウィーニングの長期化、病院での死亡率など、転帰悪化のリスクを著しく高めます。[1]、[2] 注目すべきは、23~84% の患者が最初の自発呼吸トライアルで深刻な横隔膜損傷を発症することです。[3] ある研究では、横隔膜損傷を示す患者の平均換気時間は 576 時間で、損傷のない患者の場合は 203 時間であることが示されました。[4]
主な原因は、2 つの要因によってもたらされると考えられています。[1] 場合によっては、患者が呼吸困難になり、これが横隔膜の肥厚につながることがあります。他の例としては、治療の早い段階で、患者に過剰補助および/または強制換気を行うことで、呼吸活動が過剰に減少し萎縮が引き起こされます。 どちらの変化も転帰を悪化させます。今日の臨床医にとっての課題は、一般に使用されている人工呼吸器の診断が、この情報を取得できないことです。
現在の人工呼吸器の診断では十分ではない理由
人工呼吸器の波形は、患者の呼吸ニーズを理解するために使用されますが、その主な機能は、患者への供給内容を示すことです。このため、自発呼吸中の非同調性、過鎮静、過補助、補助不足の検出が困難になります。
たとえば、わずか 21% の臨床医が、吸気努力の不在という形で非同調性を検出できたとの報告があります。[5] さらに、プレッシャーサポートによる換気を使用している患者は、実際には自発呼吸をまったく行っていないのに、自発呼吸をトリガしているように見えることがあります。[5]、[6]
その結果、患者がどれ程の呼吸努力をしているのか、また、横隔膜損傷のリスクがどの程度あるのかについての不確実性が生じます。
横隔膜のモニタ方法
横隔膜の保護に努めるには、損傷の可能性を診断し、その継続的な活動を監視する必要があります。
横隔膜の機能不全を評価するには、横隔膜の厚さと時間の経過による厚さの変化を測定する超音波検査が役立ちます。最近の超音波画像の進歩により、臨床医は横隔膜機能をより有効に評価し、機械換気中に横隔膜を保護できる可能性が高まります。[7]
横隔膜機能を連続的に呼吸ごとにモニタリングするには、横隔膜電気的活動(Edi)があります。これは、特別設計された栄養チューブを通じて得られるベッドサイドの診断ツールです。電圧信号は、患者の従来の気道内圧/フロー曲線と並んで波形として表示され、呼吸の存在、欠如および形状を示します。
Edi は、呼吸の状態を理解し、非同調性を検出し、過補助、補助不足、鎮静が呼吸機能にどの程度影響を与えているのかを評価するのに役立ちます。[8]、[9] また、介入後の呼吸努力の変化も検出することができます。たとえば、患者の体位を変えたり、サルブタモールなどの薬を投与したり、ウィーニング中に換気補助を減らしたりする場合などです。
完全な画像を得るには、超音波と連続的な横隔膜のモニタリング(Edi)を組み合わせる必要があります。
横隔膜モニタリングが患者保護とウィーニングの簡素化にいかに役立つか
人工呼吸器誘発肺損傷を避けるため、侵襲的換気、非同期性、過大/過小補助、長期間の鎮静、および横隔膜の不活動を回避する必要があります。患者は「人工呼吸器と戦い」、多くの場合負けます。鎮静が強まり、換気が長引き、場合によっては挿管になることもあります。
横隔膜モニタリングは、これらの課題への対処に役立つ可能性があります。[10]、[11]、[12] 患者の呼吸ごとの努力を確認するのに役立ちます。また、人工呼吸器が時間内に応答し、適量の補助を提供するかどうかを確認することができます。客観的で生理学的な値によるガイドがあるからです。
非侵襲的治療(NIV)では、これは人工呼吸器のタイミングと補助を適応させるのに役立ち、挿管の必要性を減らすことができます。患者と人工呼吸器の良好な相互作用は、NIV の成功の重要な要因の 1 つです。[13]
継続的なモニタリングは、呼吸努力のリアルタイムの指標としても機能し、挿管が必要な正確なタイミングを理解するのに役立ちます。自発呼吸トライアルのタイミングを最適化し、より頻繁で良好に進行させるのにも役立ちます。
横隔膜モニタリングが人工呼吸器の使用時間短縮にどのように役立つか
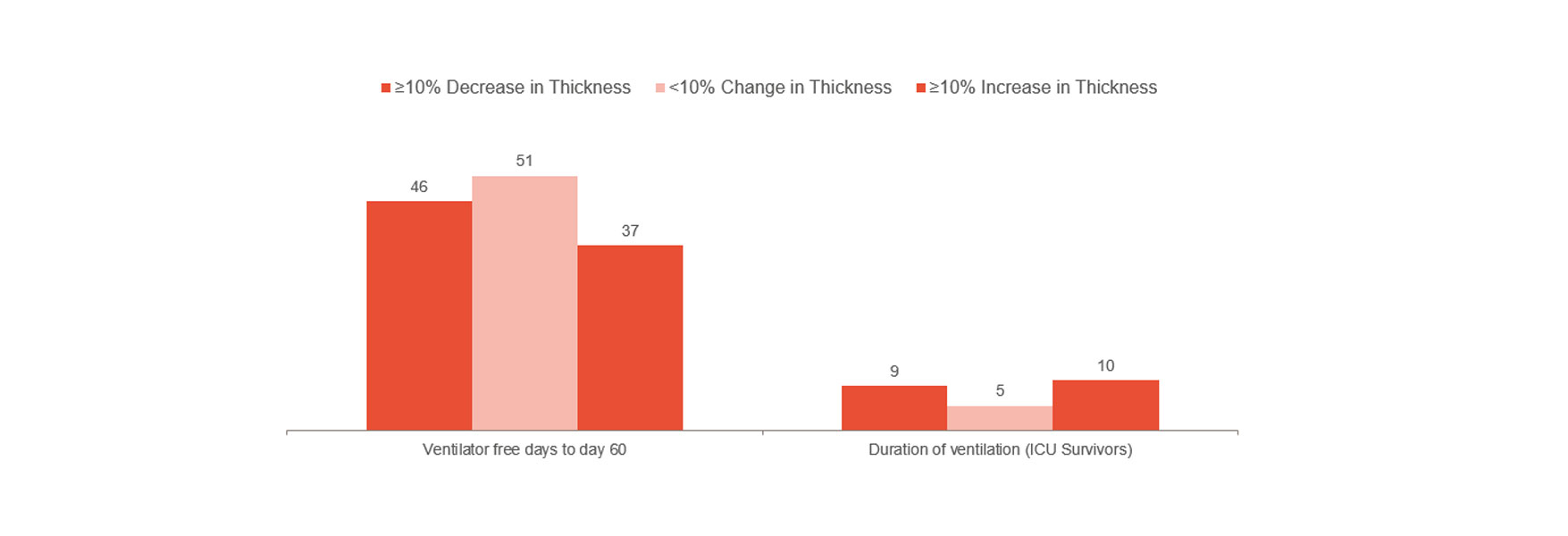
Goligher は、横隔膜の厚さの早期変化が、ICU 滞在期間、再挿管、気管切開、長期にわたる機械換気、死亡などの合併症の指標となることを示しました。[1] これは、肥厚率を 10~20% 内に維持することが最適である可能性を示しています。このように、患者リスクの指標を示し、治療を最適化するのに役立ちます。横隔膜損傷回避による合併症予防の可能性についてさらに理解するには、無作為化された臨床試験が必要です。
ただし、上記と一致するのはロンドン病院の臨床経験で、横隔膜活動のモニタリング時に、機械換気に費やされる時間が大幅に短縮されたことを示しています。[14] モニタリングされていないグループは、機械換気の中央値が 12日であるのに比べて、モニタリングされていたグループ(493 人の患者のうち103 人)の中央値は 9 日でした。
横隔膜モニタリングが、情報に基づく治療方針の決定にどのように役立つか
横隔膜活動のモニタリングは、患者のために治療全体でより多くの情報に基づいた意思決定を下すのに役立ち、多くの意思決定ポイントで貴重な情報を提供します。
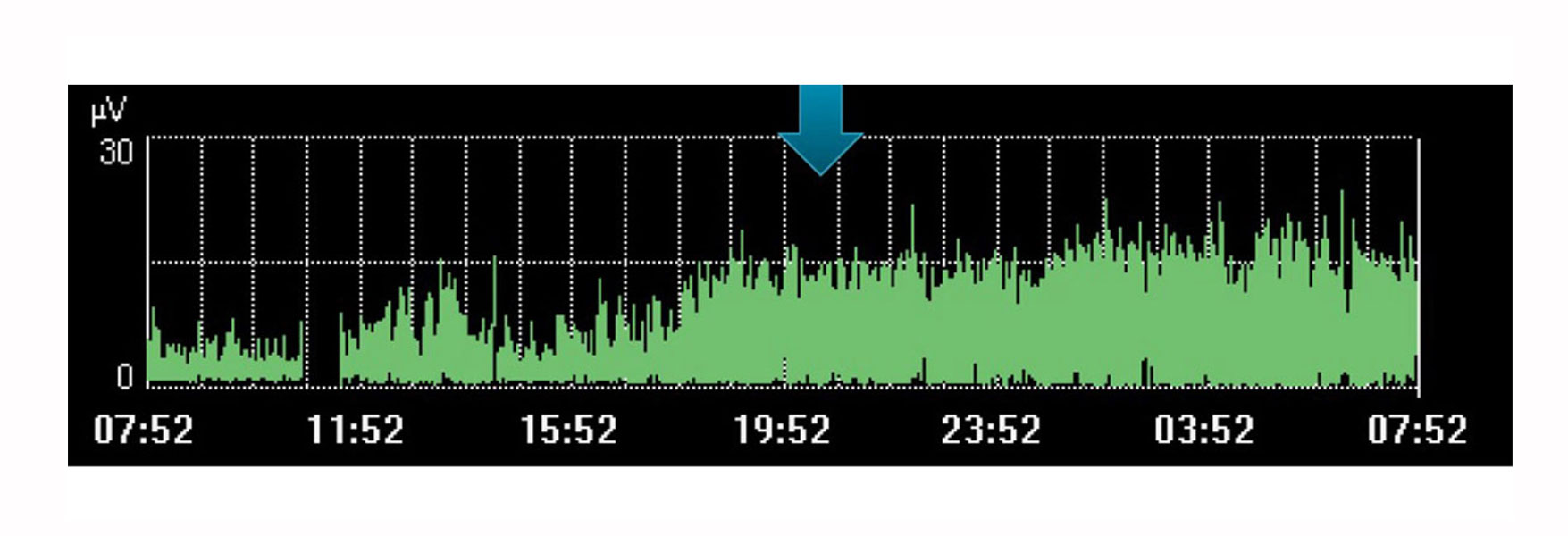
呼吸のモニタリングと傾向の把握
最近の報告では、Edi による横隔膜モニタリングが、呼吸努力と患者-人工呼吸器相互作用のモニタリングに有益であることが示されています。[18]
もちろん、Edi モニタリングには、単一の独立した値としての制限があります。他の生理的変数と同様に、他の測定値や治療法の変化という観点から検討する必要があります。時間の経過に伴う傾向は、患者が望ましい方向に進んでいるかどうかを判断するのに役立ちます。
たとえば、上記の画像は、医師が患者のために安静を計画した場合の、横隔膜の努力の増加を示しています。この傾向は、それが発生しなかったことを示しており、この間に患者によってなされた努力の増加によって可視化されます。
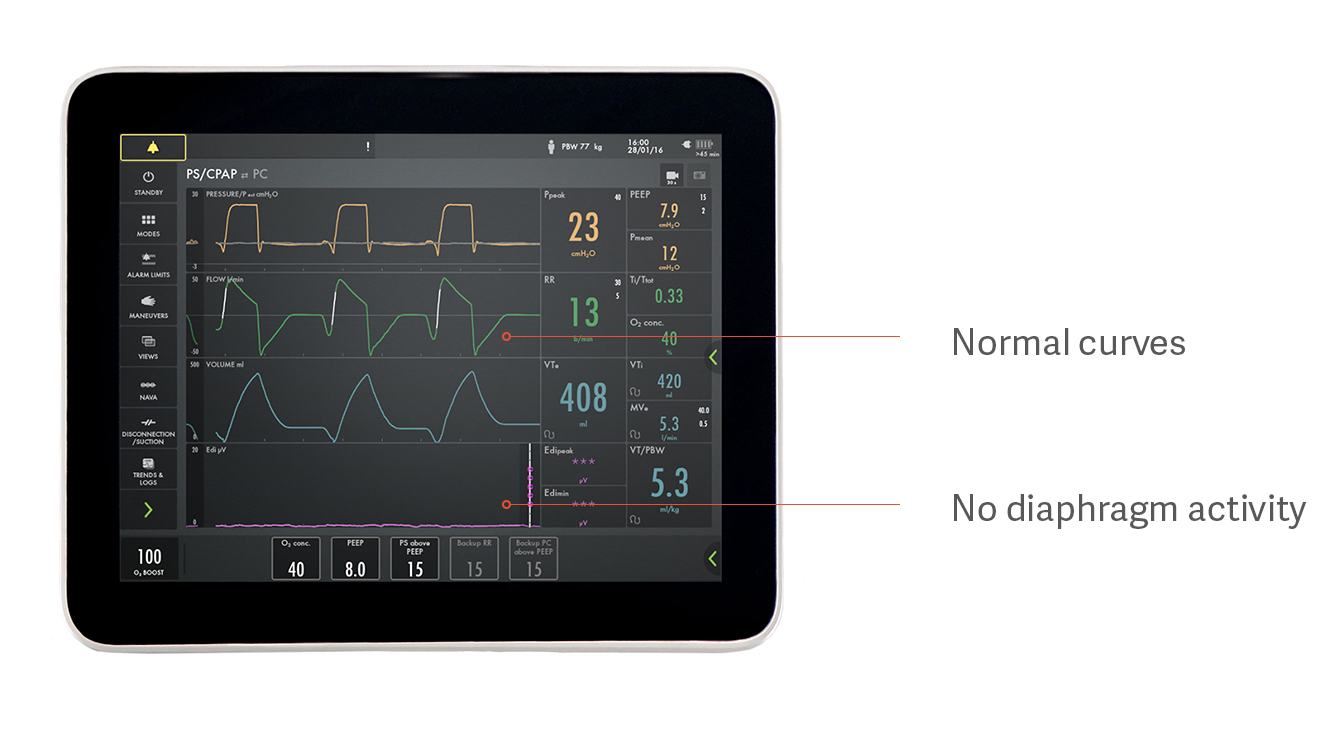
過剰補助と不十分な補助の特定
横隔膜の損傷を防ぐため、横隔膜の活動は、適切なレベルで行われる必要があります。横隔膜のモニタリングなしで、これを見分けることは困難です。
たとえば、患者はプレッシャーサポートで自発呼吸しているように見えますが、実際は上図に示すように、横隔膜をまったく使用していません。これは、過剰補助が、いかに横隔膜の活動を妨げ、その結果横隔膜を萎縮させるかを説明する一例です。気道内圧、フローおよび換気量曲線は正常に見えますが、下部の紫色の Edi 信号はフラットで、横隔膜が活動していないことを示しています。
もう一つの例は、補助不足です。これは、過剰補助の反対であり、患者にとっては同様に悪いものです。補助不足の患者は、呼吸するための労力が大きすぎて、横隔膜の肥厚が生じます。これはおそらく患者で観察したほうが簡単ですが、人工呼吸器の客観的な値なしでは、正確な把握は困難です。
横隔膜損傷(萎縮と肥厚)のいずれの例も、患者に頻繁に見られ、臨床転帰の悪化に関連しています。[1]
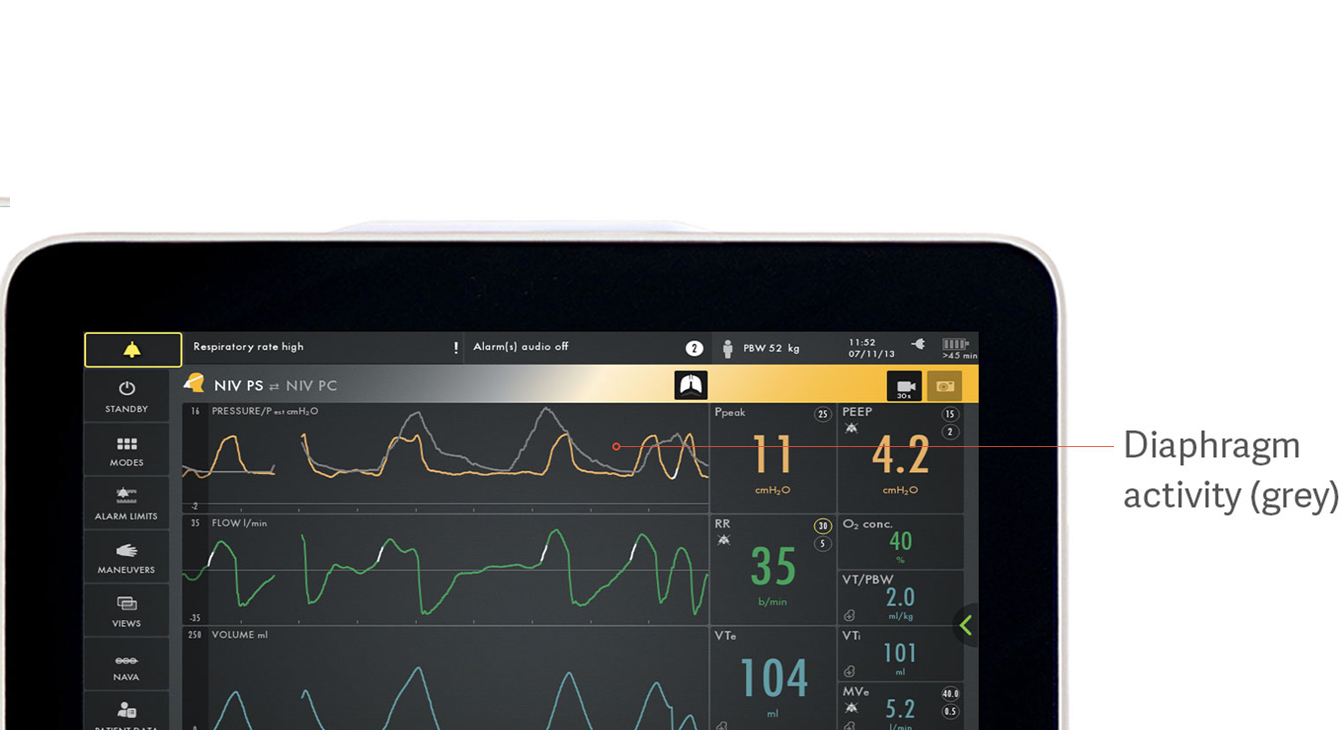
患者‐人工呼吸器非同調性の検出
非同調性は、機械換気中の臨床転帰不良と関連しています。[18] 最近の研究で、吸気努力の不在という形で、非同調性をなんとか検出することができたのは、わずか 21% の臨床医であったことが示されました。[5] 以下のように、多くの種類の見過ごしやすい非同調性があります:ミストリガー、吸気努力の遅れ、サイクルオフの遅れ、ダブルトリガーおよびオートトリガーなどです。
この画像は、灰色の横隔膜の電気的活動が圧力曲線 (黄色) とどのように重なるかを示しており、患者の要求と人工呼吸器による供給間の違いを簡単に確認できます。
換気モードの決定
患者の呼吸努力を過不足なく最適に維持することが目標です。[1] 横隔膜活動の継続的なモニタリングにより、患者の活動の状態を知ることができます。横隔膜の活動レベルが高く、上昇している場合、補助レベルを上げる必要があるかもしれません。[19]、[20]、[21]
活動レベルが低いか減少している場合は、補助レベルを下げることが可能です。[19] 補助レベルを変更する前に、換気に関連する他の診断パラメータをモニタリングすることも重要です。この分野での研究が進んでいます。今後、横隔膜パラメータに関する知識が増えるにつれて、評価がさらに改善される可能性があります。[22]
最適な PEEP の設定
自発呼吸中の患者の PEEP を設定する標準的な方法はありません。しかし、適切に設定された PEEP は、無気肺を減少させ、気道を周期的に開閉して、肺胞を保護します。これにより、ラングメカニクスが最適化され、酸素化が改善されます。
横隔膜モニタリングによる PEEP 滴定は、新生児で明確な結果を示しました。赤ちゃんは呼吸の間適切にリラックスすることができ、肺デリクルートメントを防ぐことができました。[12]
成人患者の場合、Passath は PEEP 変更中に横隔膜と酸素のモニタリングを使用することで、最小限の努力で一回換気が発生する PEEP レベルの特定を可能にしました。[23] PEEP の過度の降下は、酸素化の悪化とともに呼吸仕事量を 50~60% 増加させ、部分的な肺のデリクルートメントも示唆されました。
鎮静管理の最適化
鎮静に関連して横隔膜活動をモニタリングすることの主な利点は、横隔膜を可能な限りアクティブに維持することにあります。[1] 患者の横隔膜活動と換気への反応を監視するだけで、横隔膜活動の持続に適切な鎮静レベルを特定することができます。
横隔膜機能に影響を与える可能性のある他の生理機能と鎮静効果を区別するには、ある程度のトレーニングが必要になる場合がありますが、Edi は、患者が行った呼吸努力の変化を継続的に確認できるため、鎮静が保持される場合に特に有効です。
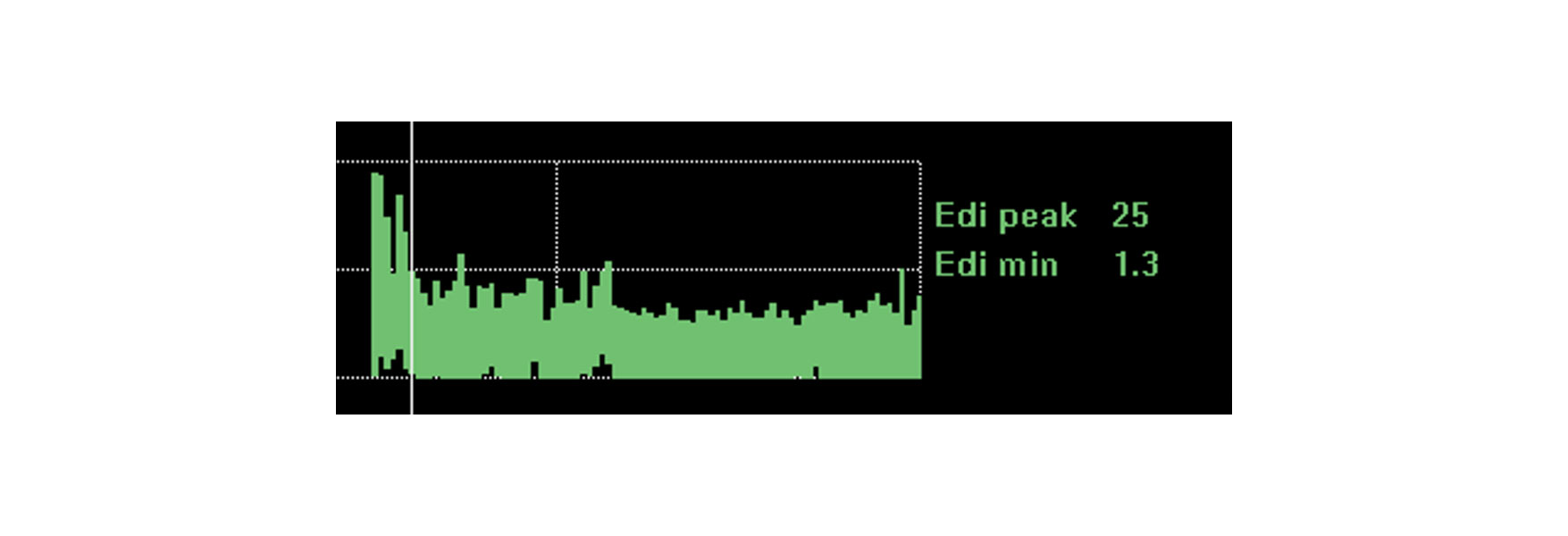
傾向と介入、安静、リハビリテーションの影響の監視
横隔膜活動のモニタリング機能は、医師が行った変更に患者が対処できるという、さらなる安心感を提供します。横隔膜活動は、安静、座位、歩行、カフェイン治療、さらには包括的なリハビリテーションや回復など、様々な生理学的な変化の影響を受けます。
患者がこれらの変化に対応している場合、横隔膜の活動は、ほぼ変化のない状態である可能性があります。臨床状況が悪化し、より大きな呼吸仕事量が必要となることで、横隔膜活動が増加する可能性が高くなります 安静位置を改善することで、呼吸に必要な横隔膜の活動が低下します。
画像は、肺炎後の急性呼吸困難のために挿管されようとしていた患者の連続的な横隔膜活動を示しています。横隔膜活動をモニタリングすることで、臨床医はサポートを最適化して状況を好転させることができました。