Hur övervakning av diafragma kan hjälpa dig att förbättra den mekaniska ventilationen
Andningsstöd är en livräddande åtgärd på IVA, men utan rätt balans ökar det också risken för skadliga resultat.[1],[2] Det är i det här läget som övervakning av diafragma kan vara till hjälp, eftersom det är en markör för resultat såsom sjukhusdödlighet och långvarig urträning. Dessutom kan det hjälpa dig att fatta mer välgrundade behandlingsbeslut under hela respirationsbehandlingen.
Den kliniska effekten av skada på diafragman
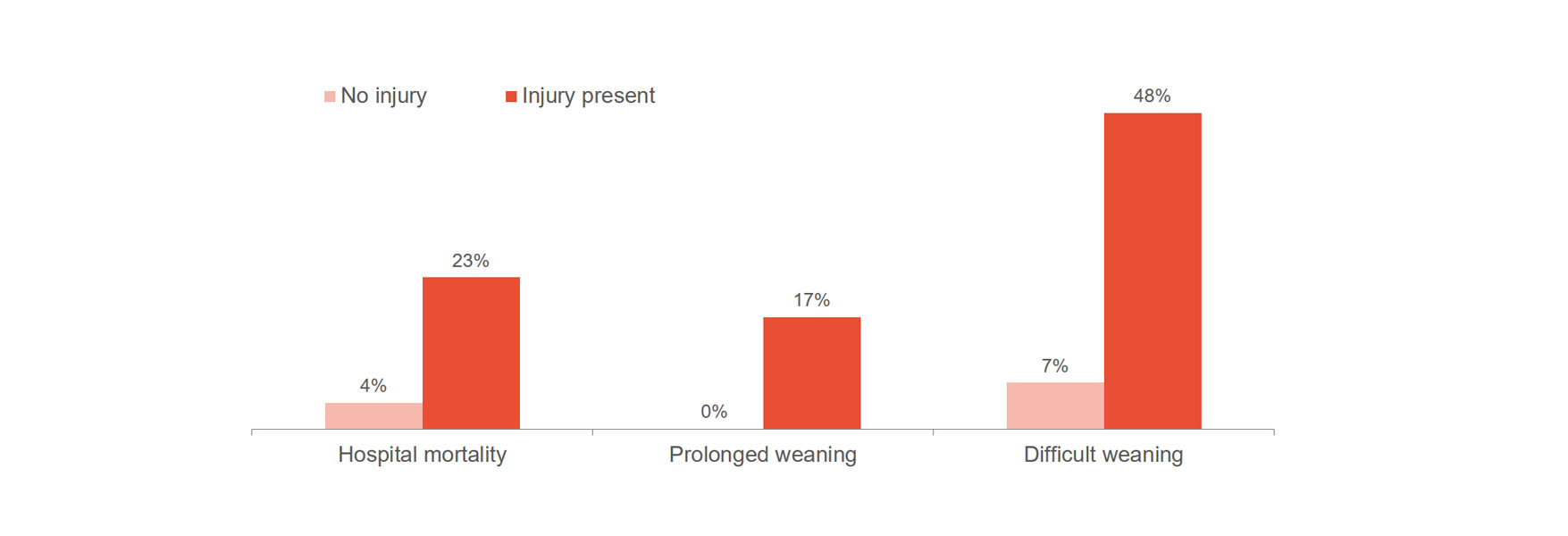
Skada på diafragman ökar påtagligt risken för försämrade utfall, såsom svårighet med urträning, förlängd urträning och sjukhusdödlighet.[1],[2] Viktigt att notera är att 23–84 % av patienterna uppvisar betydande skador på diafragman vid det första försöket till spontanandning.[3] En studie visade en genomsnittlig ventilationstid på 576 timmar för patienter med skada på diafragman, jämfört med 203 timmar för patienter utan skada.[4]
Huvudorsakerna till detta tros handla om två faktorer.[1] I vissa fall arbetar patienterna för hårt för att andas, vilket leder till förtjockning av diafragman. I andra fall arbetar patienterna för lite efter att de haft för mycket stöd och/eller kontrollerad ventilation tidigt i behandlingen, vilket leder till atrofi. Båda dessa förändringar ledde till försämrade resultat, och utmaningen för läkare idag är att vanlig ventilatordiagnostik inte klarar av att fånga upp denna information.
Varför nuvarande ventilatordiagnostik inte är tillräcklig
Ventilations kurvor används för att tolka patientens andningsbehov, men deras primära funktion är att visa hur du ventilerar din patient med aktuella inställningar. Detta gör det svårt att upptäcka asynkroni, översedering, samt för mycket eller för lite stöd under spontanandning.
Till exempel upptäcker endast 21 % av läkarna asynkroni i form av missade inandningsförsök.[5] Dessutom kan en patient som står på tryckunderstödd ventilation se ut att trigga spontana andetag, när hon eller han i verkligheten inte triggar några spontana andetag överhuvudtaget.[5], [6]
Resultatet är osäkerhet om hur mycket patient anstränger sin andning och i vilken utsträckning hon eller han riskerar att skada diafragman.
Så här övervakar du diafragman
För att försöka skydda diafragman måste du diagnostisera den potentiella skadan och övervaka diafragmans kontinuerliga aktivitet.
Ett ultraljud hjälper dig att bedöma diafragmans dysfunktion genom att mäta dess tjocklek och eventuella förändringar av tjockleken över tid. De senaste framstegen inom ultraljudsmätning gör det möjligt för läkare att på ett mer genomförbart sätt bedöma diafragmans funktion och eventuellt skydda diafragman under mekanisk ventilation.[7]
För kontinuerlig övervakning av diafragmans funktion – andetag för andetag – finns Edi (Electrical activity of the diaphragm). Det är ett diagnosverktyg intill sängen som erhållits genom en specialdesignad matningssond. Spänningssignalen visas som en vågform bredvid patientens konventionella tryck-/flödeskurvor och visar närvaro, frånvaro och typ av andning.
Edi kan hjälpa dig att förstå andningsarbetet, upptäcka asynkronier och bedöma i vilken utsträckning för mycket eller för lite stöd och sedering påverkar andningsförmågan.[8],[9] Du kan också upptäcka förändringar i ansträngningen efter interventioner. Exempel på detta är när du ändrar patientens läge, administrerar läkemedel som Salbutamol eller ytterst när du minskar ventilationsstödet under urträningen.
Det är troligt att en kombination av ultraljud och kontinuerlig diafragmaövervakning (Edi) krävs för att få en övergripande bild.
Hur diafragmaövervakning kan hjälpa till att skydda patienten och förenkla urträning
För att undvika ventilatorinducerad lungskada vill du försöka undvika invasiv ventilation, asynkroni och för mycket eller för lite stöd samt längre perioder av sedering och inaktivitet av diafragman. Patienter som ”kämpar mot ventilatorn” förlorar ofta. Ökad sedering, förlängd ventilation och eventuellt intubering tenderar att bli resultatet.
Diafragmaövervakning kan innebära en hjälp för att hantera dessa utmaningar.[10],[11],[12] Det hjälper dig att se patientens ansträngningar, andetag för andetag. Och du kan se om ventilatorn svarar i tid, med rätt mängd stöd, eftersom du har ett objektivt, fysiologiskt värde som vägleder dig.
Vid icke-invasiv behandling kan detta hjälpa dig att anpassa ventilatorns inställningar, så som inspirationstid och volym, vilket kan minska behovet av intubation. God interaktion mellan patient och ventilator är en av de viktigaste faktorerna för framgångsrik NIV.[13]
Kontinuerlig övervakning kan också fungera som en indikator i realtid för hur ansträngd andningen är och hjälpa dig att förstå när intubering verkligen är nödvändigt. Det kan till och med hjälpa dig att optimera tidpunkten för spontana andningsförsök samt att utveckla dem mer framgångsrikt.
Hur övervakning av diafragma kan hjälpa till att minska tiden med ventilatorn
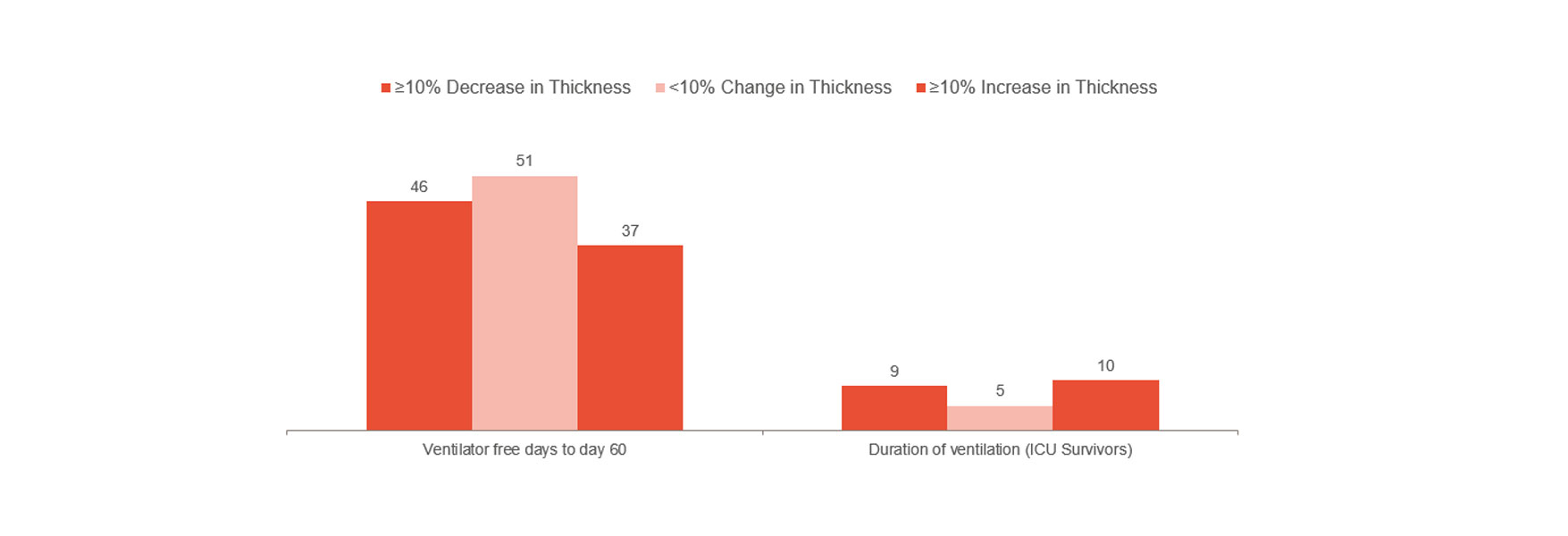
Goligher visade att tidig förändring av diafragmans tjocklek var en markör för IVA-vistelsens längd och andra komplikationer som reintubering, trakeostomi, förlängd mekanisk ventilation och dödsfall.[1] Detta tyder på att det kan vara optimalt att hålla sig inom en förtjockningsfraktion på 10–20 %. Det kan i sig ge dig indikationer på patientrisk och hjälpa dig att optimera behandlingen. För att ytterligare förstå om undvikande av skador på diafragman kan förhindra komplikationer krävs randomiserade kliniska prövningar.
I linje med ovanstående är dock den kliniska erfarenheten från ett sjukhus i London, som indikerade en signifikant minskning av tiden som ägnades åt mekanisk ventilation vid övervakning av diafragmaaktiviteten.[14] Den icke-övervakade gruppen hade en median på tolv dagar för mekanisk ventilation jämfört med en median på nio dagar för den övervakade gruppen (103 patienter av 493).
Övervakning av diafragman kan också hjälpa dig att upptäcka störningar, såsom kongenitalt centralt hypoventilationssyndrom och skador på phrenicusnerven.[15],[16]
Hur diafragmaövervakning kan hjälpa dig att fatta mer välgrundade behandlingsbeslut
Övervakning av diafragmaaktiviteten kan hjälpa dig att fatta mer välgrundade beslut för din patient under hela behandlingen och ge dig värdefull information vid ett antal tillfällen.
Övervaka och trenda andningsarbetet
De senaste rapporterna indikerar att diafragmaövervakning med Edi är användbart för att övervaka andningsansträngning och interaktion mellan patient och ventilator.[18]
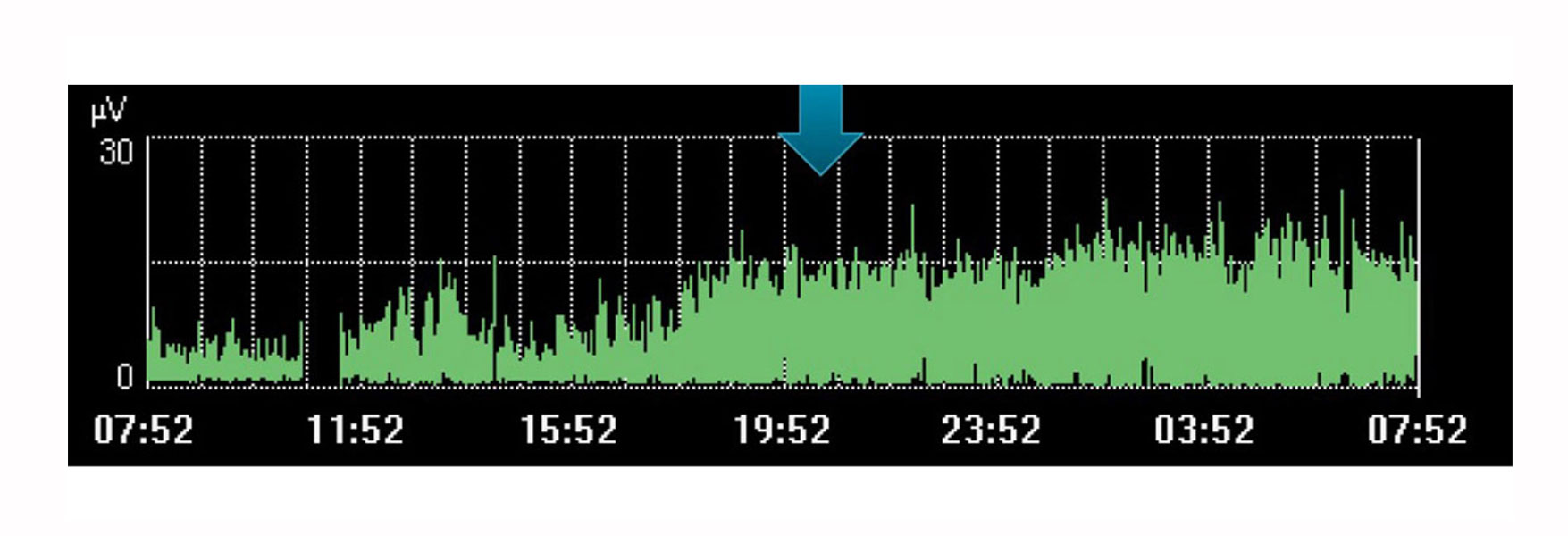
Naturligtvis har Edi-övervakning begränsningar som ett enda, isolerat värde. Precis som med andra fysiologiska variabler bör övervakning med Edi övervägas tillsammans med andra mätningar och i samband med förändringar i behandlingen – en trend över tid som kan hjälpa dig att avgöra om utvecklingen för din patient går i önskad riktning.
Bilden ovan visar till exempel en ökning av diafragmaaktivitet under en tidsperiod då läkaren hade planerat in vila för patienten. Trenden indikerar att detta inte inträffade, vilket märks genom att patientens ansträngning ökade under den här tidsperioden.
Identifiera mycket respektive för lite stöd
För att förhindra att patienten får en skada på diafragman måste diafragman vara aktiv på en lämplig nivå. Detta är svårt att se utan övervakning av diafragman.
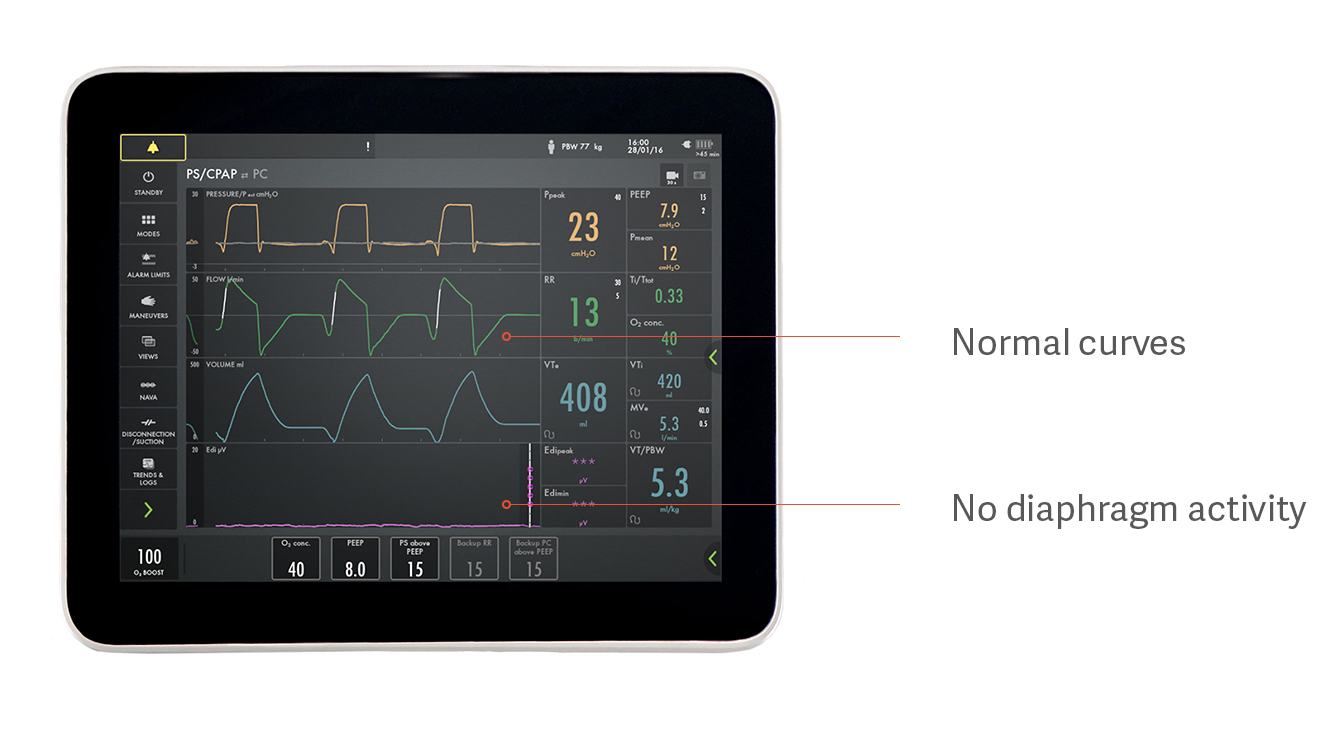
En patient kan till exempel förefalla andas spontant med tryckunderstöd, men faktiskt inte använda sin diafragma överhuvudtaget. Detta visas i bilden ovan. Detta är ett exempel på hur för mycket stöd hindrar diafragman från att fungera, vilket resulterar i diafragmaatrofi. Tryck-, flödes- och volymkurvorna ser normala ut, men den lila Edi-signalen längst ned är platt, vilket visar på en inaktiv diafragma.
Ett annat exempel är för lite stöd, vilket är motsatsen till för mycket stöd och lika dåligt för patienten. En patient som får för lite stöd anstränger sig för mycket för att andas, vilket resulterar i att diafragman förtjockas. Detta är kanske lättare att observera hos patienten, men utan ett objektivt värde på ventilatorn är det svårt att veta säkert.
Båda exemplen på skador på diafragman (atrofi och förtjockning) ses ofta hos patienter och är förknippade med försämrade kliniska resultat.[1]
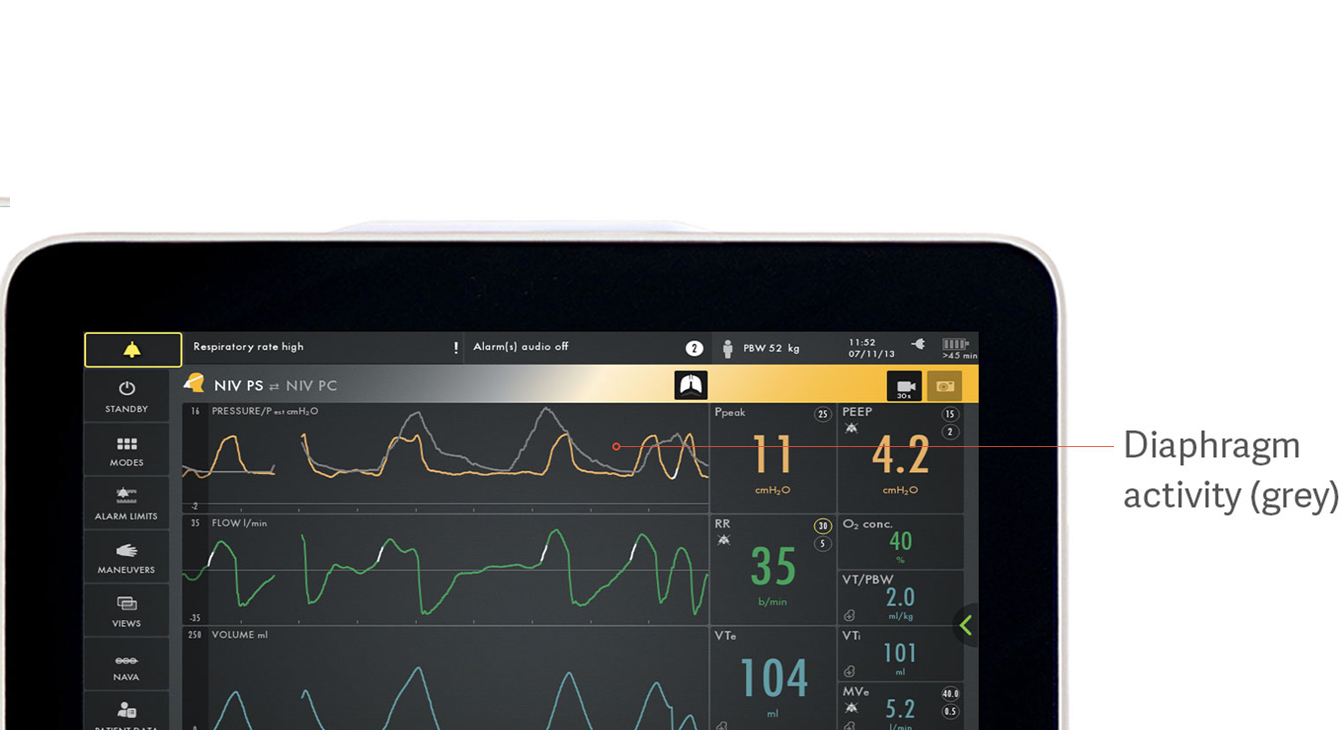
Identifiering av asynkroni mellan patient och ventilator
Asynkroni är förknippat med sämre kliniska resultat under mekanisk ventilation.[18] I en nyligen genomförd studie lyckades endast 21 % av läkarna upptäcka asynkroni av typen missade inandningsförsök.[5] Det finns dessutom många fler varianter av asynkroni som lätt förbises: ineffektiv eller överdriven andning, fördröjd inandning, fördröjd avcykling, dubbel triggning och autotriggning.
Bilden visar diafragmans elektriska aktivitet i grått över tryckkurvan i gult, vilket gör det enkelt att se skillnader i vad patienten efterfrågar och vad ventilatorn levererar.
Fastställ ventilationsmod
Ditt mål bör vara att patienten ska bibehålla en optimal andning som varken representerar för lite eller för mycket ansträngning.[1] Genom att kontinuerligt övervaka diafragmaaktiviteten får du en indikation på hur mycket patienten anstränger sig, om hon eller han alls gör det. Om diafragmaaktiviteten är hög och stigande kan du behöva öka patients nivå av andningsstöd.[19],[20],[21]
Om aktiviteten är låg eller minskar kan du eventuellt minska nivån av stöd.[19] Det är viktigt att även övervaka andra diagnostiska parametrar som är förknippade med ventilation innan du byter stöd. Forskningen ökar inom detta område. I framtiden kan mer kunskap om diafragmans funktion komma att förbättra bedömningen ytterligare.[22]
Ställ in ett optimalt PEEP
Det finns inget standardiserat sätt att ställa in patientens PEEP under spontanandning. Ändå kan ett välinställt PEEP minska atelektaser och cyklisk öppning och stängning av luftvägarna samt skydda alveolerna. Detta optimerar i sin tur lungmekaniken och förbättrar syresättningen.
PEEP-titrering med diafragmaövervakning har visat tydliga resultat hos nyfödda, vilket gör att barnet kan slappna av på lämpligt sätt mellan andetagen och förhindra derekrytering av lungorna.[12]
Hos vuxna patienter använde Passath (chest, 2010) diafragma- och syrgasövervakning under PEEP-förändringar för att möjliggöra identifiering av en PEEP-nivå vid vilken tillfredsställande tidalvolymer förekommer med minimal ansträngning.[23] En alltför kraftig sänkning av PEEP resulterade i en ökning av andningsarbetet med 50 till 60 %, vilket i kombination med försämring av oxygenering också tydde på partiell derekrytering.
Optimera hanteringen av sedering
Den största fördelen med att övervaka diafragmaaktiviteten i samband med sedering är att man försöker hålla diafragman aktiv så mycket som möjligt.1 Övervaka helt enkelt patientens diafragmaaktivitet och svar på ventilationen för att hitta en lämplig sederingsnivå med bibehållen diafragmaaktivitet.
Det kan krävas viss träning för att skilja effekten av sedering från annan fysiologi som kan påverka diafragmafunktionen, men Edi är särskilt effektivt under sederingsuppehåll eftersom du hela tiden kan se förändringarna i den ansträngning som görs av patienten.
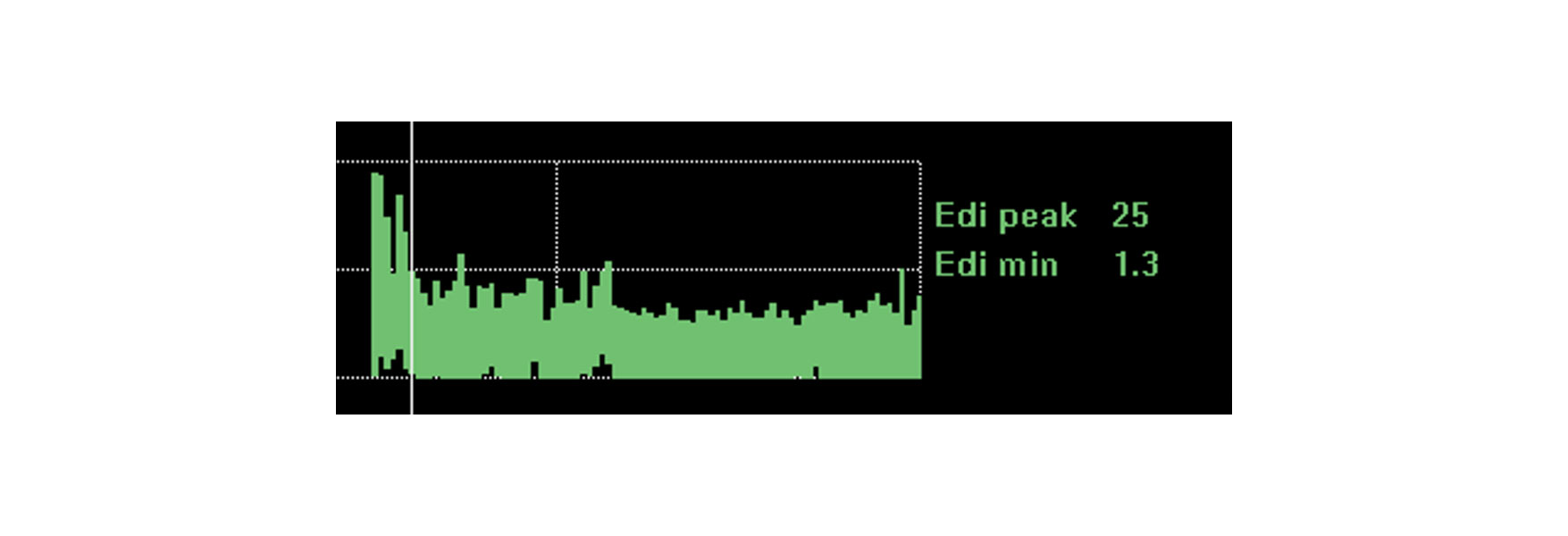
Trenda och övervaka effekten av interventioner, vila och rehabilitering
Övervakning av diafragmaaktiviteten ger en ytterligare försäkran om att patienten klarar av de förändringar du gör. Diafragmaaktiviteten påverkas av en rad fysiologiska förändringar såsom vila, sittande, gång, koffeinbehandling och till och med total rehabilitering och återhämtning.
Om patienten klarar av dessa förändringar kan diafragmaaktiviteten förbli i stort sett oförändrad. En försämring av den kliniska situationen och ett behov av ökat andningsarbete ökar sannolikt diafragmaaktiviteten. En förbättrad viloposition sänker den diafragmaaktivitet som krävs för att generera andetag.
Bilden visar den kontinuerliga diafragmaaktiviteten hos en patient som skulle intuberas på grund av akuta andningssvårigheter efter lunginflammation. Genom att övervaka diafragmaaktiviteten lyckades läkaren optimera stödet och vända situationen.
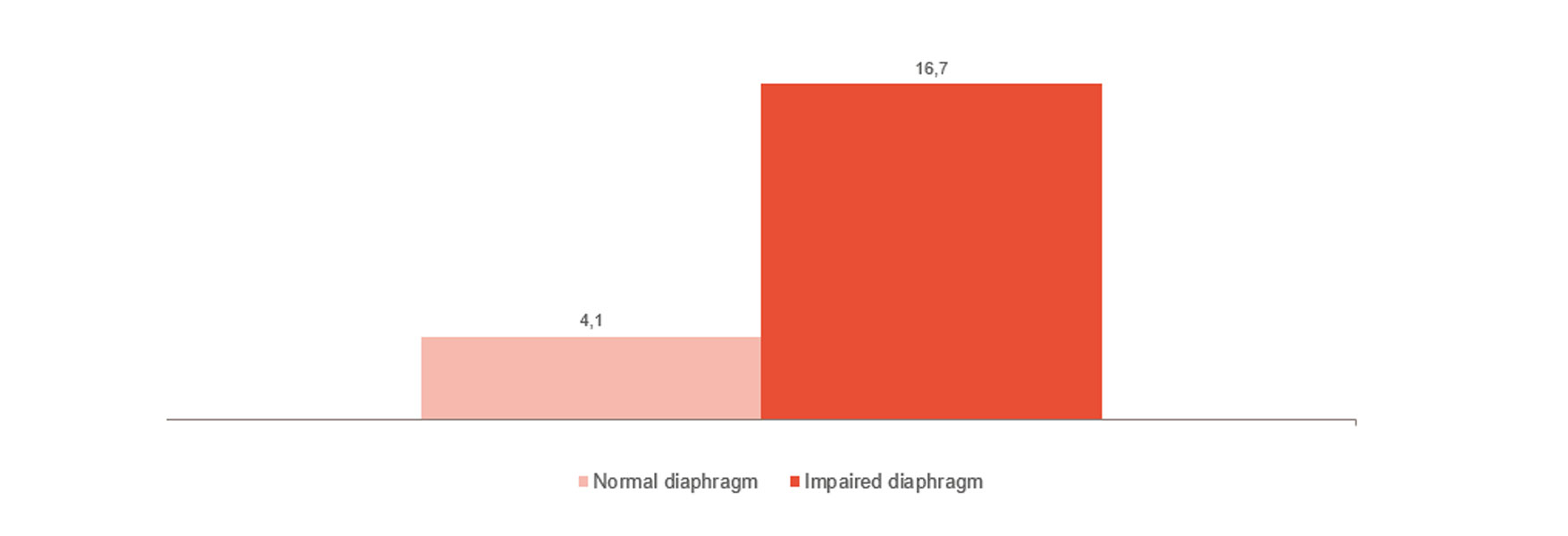
Övervaka och följa urträningen
Som bilden visar är diafragmadysfunktion starkt kopplat till svårigheter i urträning.[4] Övervakning av diafragmaaktiviteten kan hjälpa dig att förutsäga när patienten är redo för urträning och kunna övervaka dess förlopp.[24],[25],[26] Hela vägen från invasiv ventilation till icke-invasiv ventilation, högflödesbehandling och när till slut allt stöd har avlägsnats.
Patientens förmåga att hantera minskat stöd upptäcks inom några minuter och kan hjälpa dig att fortsätta eller finjustera stödet. Det kan bli nödvändigt att gå tillbaka till dina tidigare inställningar för att förhindra att patienten får återfall och därigenom undvika de komplikationer som ofta uppstår.
